
【题目】海带具有从海水中富集碘的能力。下面是从海带中提取碘单质的流程:
海带![]() 海带灰
海带灰![]() 悬浊液
悬浊液![]() 含I-的溶液
含I-的溶液![]() 含I2的溶液
含I2的溶液![]() 含I2的四氯化碳溶液
含I2的四氯化碳溶液![]() 晶体碘
晶体碘
(1)在上述流程中,属于过滤操作的是___(用a、b、c、d表示,下同),属于萃取操作的是___。
(2)现有烧杯、玻璃棒和必需的夹持仪器,完成过滤操作尚缺少的玻璃仪器是___,完成萃取操作还需要的玻璃仪器是___。
(3)写出含I-的溶液中通氯气后发生反应的离子方程式:___。
(4)含I2的水溶液中加入四氯化碳,振荡后静置,观察到溶液分层,下层溶液显___。
(5)四氯化碳能从碘水中萃取出碘的原因是①___,②___,③___。
【答案】c d 漏斗 分液漏斗 Cl2+2I-=I2+2Cl- 紫红色 四氯化碳与水不互溶 混合时溶液分层 碘在四氯化碳中的溶解度比在水中的溶解度大得多
【解析】
由提取海带中的碘的实验流程可知,a海带在坩埚中灼烧,b为加入水溶解得到悬浊液,步骤c为过滤,得到含碘离子的溶液,通入氯气氧化碘离子得到含碘单质的溶液,d加入四氯化碳萃取分液,得到含碘单质的四氯化碳溶液,通过蒸馏提纯得到碘单质,
(1)由上面分析可知,在上述流程中,属于过滤操作的是c,属于萃取操作的是d,
故答案:c;d;
(2)步骤c的操作是过滤,用于分离固体和溶液,该操作中涉及到的玻璃仪器有漏斗、烧杯和玻璃棒,完成萃取操作还需要的玻璃仪器是分液漏斗,
故答案为:漏斗;分液漏斗;
(3)含I-的溶液中通氯气后发生反应的离子方程式:Cl2+2I-=I2+2Cl-,
故答案:Cl2+2I-=I2+2Cl-;
(4)四氯化碳比水重在溶液下层,操作时在含I2的溶液中加入四氯化碳,振荡、静置后,液体分为两层,下层液体呈紫红色,
故答案为:紫红色;
(5)四氯化碳能从碘水中萃取出碘的原因是:四氯化碳与水不互溶;混合时溶液分层;碘在四氯化碳中的溶解度比在水中的溶解度大得多,
故答案:四氯化碳与水不互溶;混合时溶液分层;碘在四氯化碳中的溶解度比在水中的溶解度大得多;


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种有机盐 X(仅含四种元素)的组成与性质,设计并完成如下实验:

已知: A、 B、 C 均为常见物质。气体 A 为无色无味混合气体,两种气体组成元素相同。
(1)有机盐 X 的化学式为_________
(2)写出 X 受热分解的化学方程式_________
(3)一定条件下,固体 C 与气体 A 中的某一成分可能发生某一氧化还原反应生成红棕色_________固体,写出此反应可能的化学方程式_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】深入研究碳元素的化合物有重要意义,回答下列问题:
(1)在恒温、恒容密闭容器中加入H2C2O4,发生反应:H2C2O4(s)![]() CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是________。
CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是________。
A.压强不再变化
B.CO2(g)的体积分数保持不变
C.混合气体的密度不再变化
D.混合气体的平均摩尔质量保持不变
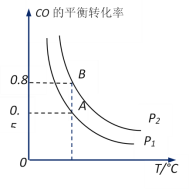
(2)工业上可以通过反应CO(g)+2H2(g)![]() CH3OH(g)制备甲醇。在一容积可变容器中充入2molCO和4molH2,CO的平衡转 化率随温度(T)、压强(P)的变化关系如图所示。该反应的H_______0(填“>”、“<”或“=”),比较A点时用CO表示的正反应速率与B点时用CH3OH表示的逆反应速率的大小v正(CO)____v逆(CH3OH)(填“>”、“<”或“=”)。若在压强P1下达到化学平衡状态A时,容器的体积为10L。如果反应开始时仍充入2molCO和4molH2,则在压强P2下达到平衡状态B时容器的体积V(B)=________L。
CH3OH(g)制备甲醇。在一容积可变容器中充入2molCO和4molH2,CO的平衡转 化率随温度(T)、压强(P)的变化关系如图所示。该反应的H_______0(填“>”、“<”或“=”),比较A点时用CO表示的正反应速率与B点时用CH3OH表示的逆反应速率的大小v正(CO)____v逆(CH3OH)(填“>”、“<”或“=”)。若在压强P1下达到化学平衡状态A时,容器的体积为10L。如果反应开始时仍充入2molCO和4molH2,则在压强P2下达到平衡状态B时容器的体积V(B)=________L。
(3)从平衡移动的角度分析AlCl3溶液可以溶解CaCO3固体的原因是_________________
(4)常温下,测得某CaCO3的饱和溶液pH=10.0,忽略CO32-的第二步水解,计算Ksp(CaCO3)=__________(保留三位有效数字)(已知:Ka1(H2CO3)=4.4×10-7Ka2(H2CO3)=4.7×10-11)
(5)有一种可充电电池Na-Al/FeS,电池工作时Na+的物质的量保持不变,并且用含Na+的导电固体作为电解质,已知该电池的正极反应式为2Na++FeS+2e-=Na2S+Fe, 则放电时负极反应式为____________________。该电池充电时,当转移2mol电子时,阳极质量的变化量为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上制备氯化氢气体的化学方程式为___。
(2)实验室用氯化钠与浓硫酸反应制氯化氢气体的方程式___,利用浓硫酸___性。要制得干燥的氯化氢气体,可选用___做干燥剂。
(3)用如图装置进行实验,烧瓶内充满干燥的HCl气体,挤压预先装满水的胶头滴管后,还应该进行的操作是___,能观察到___现象。

(4)标准状况下,用容积为V升的圆底烧瓶,采用排空气法收集干燥的氯化氢,所得气体的平均式量是34.625。喷泉实验后,烧瓶中的溶液的体积为___,物质的量浓度___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组的学生在实验室用二氧化锰和浓盐酸反应来制取氯气,装置如图:

(1)写出实验室制取氯气的化学反应方程式___。
(2)为了除去氯气中的少量氯化氢气体,可以在收集氯气之前,让氯气经过___(填试剂序号)。为吸收残余氯气,可在烧杯中加入___(填试剂序号)。其化学方程式是___。
A.水 B.浓硫酸 C.饱和食盐水 D.烧碱溶液
(3)兴趣小组成员甲同学认为,此反应装置还可以用来制取___(填编号)。
A.氧气 B.氢气 C.二氧化碳 D.氯化氢
但是,成员乙同学认为,要用整套装置来制取甲同学提出的气体,必须改进其中的___(填编号),理由是___。
A.气体的发生装置 B.气体的收集装置 C.尾气吸收装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素A的一价阴离子的电子层结构与氩原子相同,元素B的二价阳离子的电子层结构与氖原子相同。请回答:
(1)元素A离子的结构示意图为___,A的单质呈___色,检验该物质的方法是___。
(2)由A、B形成的化合物的电子式是___。
(3)与A离子具有相同电子数的一种分子是___(填名称)。
(4)A的单质与Ca(OH)2反应的化学方程式___,该反应工业上的用途是___。
(5)蓝色石蕊试纸遇到A的水溶液现象是___,请你解释这个现象___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构.请回答下列问题.
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:

则,A的化合价__B的化合价(填“>”、“<”或“=”).
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:

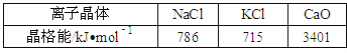
则该 4种离子晶体(不包括NaCl)熔点从高到低的顺序是:__.
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是___________________________.
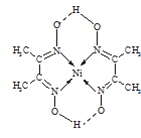
(4)某配合物的分子结构如图所示,则N原子的杂化方式为__;基态Ni原子的电子排布式__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列事实中,各是什么因素影响了化学反应的速率。
(1)黄铁矿煅烧时要粉碎成细小颗粒______________;
(2)夏天的食品变霉,在冬天不易发生该现象_____________;
(3)同浓度同体积的盐酸中放入同样大小的锌粒和镁块,产生气体快慢程度不同__;
(4)同样大小的石灰石分别在0.1 mol·L-1的盐酸和1 mol·L-1的盐酸中反应速度不同_____________;
(5)熔化的KClO3放出气泡很慢,撒入MnO2少量很快产生气体__________;
(6)如下图,铁在海水中的腐蚀速度是②比①快______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2A(s) ![]() B(g)+C(g),在一定条件下的刚性密闭容器中,起始时加入一定量的A,能判断反应达到平衡状态的有( )
B(g)+C(g),在一定条件下的刚性密闭容器中,起始时加入一定量的A,能判断反应达到平衡状态的有( )
①单位时间内生成2molA的同时生成1molB ②v (B): v (C)=1:1 ③密闭容器中混合气体的平均摩尔质量不变 ④混合气体的密度不再改变 ⑤B的体积分数不再改变 ⑥混合气体的压强不再改变
A. 3个 B. 4个 C. 5个 D. 6个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com