
【题目】某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):
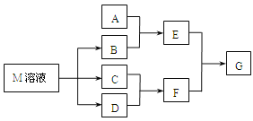
(1)写出用惰性电极电解M溶液的离子方程式__________。写出F的电子式___________。
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是______________。
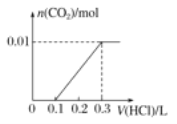
(3)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,如图所示,“则A与B溶液”反应后溶液中的溶质化学式为________。
【答案】2Cl﹣+2H2O![]() 2OH﹣+H2↑+Cl2↑
2OH﹣+H2↑+Cl2↑![]() 水玻璃Na2CO3和NaHCO3
水玻璃Na2CO3和NaHCO3
【解析】
C可在D中燃烧发出苍白色火焰,为氢气与氯气反应生成HCl,可推知C为H2、D为Cl2、F为HCl,M是日常生活中不可缺少的调味品,由转化关系可知,M的溶液电解生成氢气、氯气与B,可推知M为NaCl、B为NaOH。
(1)用惰性电极电解氯化钠溶液得到氢氧化钠溶液、氢气和氯气,电解的离子方程式为2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;F为HCl, HCl为共价化合物,分子中H原子与Cl原子之间形成1对共用电子对,电子式为
2OH-+H2↑+Cl2↑;F为HCl, HCl为共价化合物,分子中H原子与Cl原子之间形成1对共用电子对,电子式为![]() 。(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,E为Na2SiO3,与HCl溶液反应可以制备G为H2SiO3,E的溶液俗称水玻璃。若A是CO2气体,CO2与NaOH溶液能够反应生成碳酸钠或碳酸氢钠或两者的混合物,也有可能氢氧化钠过量,根据反应后所得的溶液再与盐酸反应产生气体的图2所示可知,盐酸体积为0.1L时没有气体,而用了0.2L的盐酸产生气体,碳酸钠溶液生成碳酸氢钠的用掉的盐酸与碳酸氢钠产生二氧化碳用的掉的盐酸相等,由此判断反应后溶液中的溶质为Na2CO3和NaHCO3。
。(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,E为Na2SiO3,与HCl溶液反应可以制备G为H2SiO3,E的溶液俗称水玻璃。若A是CO2气体,CO2与NaOH溶液能够反应生成碳酸钠或碳酸氢钠或两者的混合物,也有可能氢氧化钠过量,根据反应后所得的溶液再与盐酸反应产生气体的图2所示可知,盐酸体积为0.1L时没有气体,而用了0.2L的盐酸产生气体,碳酸钠溶液生成碳酸氢钠的用掉的盐酸与碳酸氢钠产生二氧化碳用的掉的盐酸相等,由此判断反应后溶液中的溶质为Na2CO3和NaHCO3。


科目:高中化学 来源: 题型:
【题目】生活中处处有化学。请根据你所学过的化学知识,判断下列说法中不正确的是
A.医疗上常用体积分数为75%的酒精作消毒剂
B.为防止流感传染,可将教室门窗关闭后,用食醋熏蒸,进行消毒
C.氯化钠是家庭常用的防腐剂,可用来腌制食品
D.使用液化石油气不会造成厨房空气污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将反应Cu(s)+2Ag+(aq)![]() Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是
Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是
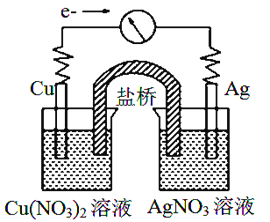
A. KNO3盐桥中的K+移向Cu(NO3)2溶液
B. 工作一段时间后,AgNO3溶液中c(Ag+)减小
C. 电子由AgNO3溶液通过盐桥移向Cu(NO3)2溶液
D. Cu作负极,发生还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图。请回答:
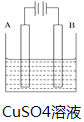
(1)A电极对应的金属是______________(写元素名称),B电极发生__________(氧化或还原)反应,电极反应式是__________________
(2)镀层破损后,镀铜铁比镀锌铁更_____________被腐蚀(填“容易”“不容易”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置:
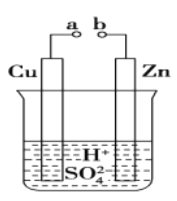
(1)a和b用导线连接,Zn极为原电池__________极(填“正”或“负”),Cu极发生__________(填“氧化”或“还原”),溶液中SO42-移向_________(填“Cu”或“Zn”)极
(2)无论a和b是否连接,Zn片均被腐蚀。若转移了0.4mol电子,则理论上Zn片应溶解__________g
(3)有同学想把Ba(OH)2·8H2O晶体与NH4NO3晶体的反应设计成原电池,你认为是否可行?__________(填“是”或“否”),理由是 __________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。

相关信息:①四氯化硅遇水极易水解;②SiCl4沸点为57.7℃,熔点为-70.0℃。请回答:
(1)写出装置A中发生反应的离子方程式___________________________________________。
(2)装置C中的试剂是______________;装置F的作用是_____________________________;
装置E中的h瓶需要冷却的理由是_____________________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中含有铁元素,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
①反应的离子方程式:______________。
②滴定前是否要滴加指示剂?_____(填“是”或“否”),请说明理由___________________。
③滴定前检验Fe3+是否被完全还原的实验操作是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:
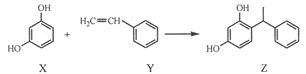
下列叙述错误的是
A. X、Y和Z均能使溴水褪色
B. X和Z均能与NaHCO3溶液反应放出CO2
C. Y既能发生取代反应,也能发生加成反应
D. Y可作加聚反应单体,X可作缩聚反应单体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①NO+NO2+2OH-=2NO2—+H2O
②气体液化的温度:NO2为21 ℃,NO为-152 ℃
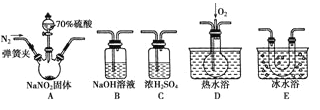
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接)为A、C、________、______、______。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是________________ 。
(3)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是________________________________________。
②装置E的作用是________________________________________________________________。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为_______________________。
如果没有装置C,对实验结论造成的影响是__________________________________________。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、环境密切相关。如图为雾霾的主要成分示意图。下列说法不正确的是

A. 雾属于胶体,能产生丁达尔效应
B. SO2 和 N xOy 都属于酸性氧化物
C. 汽车尾气的大量排放是造成雾霾天气的人为因素之一
D. 重金属离子可导致蛋白质变性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com