
【题目】元素周期的形式多种多样,如图是扇形元素周期表的一部分,对比中学常见元素周期表,分析其元素的填充规律,判断下列说法正确的是( ) 
A.③元素形成的单质晶体均属于原子晶体
B.④元素的气态氢化物易液化,是因为其分子间存在氢键
C.②、⑦、⑧对应的简单离子半径依次减小
D.实验室可根据⑥、⑦单质分别与⑤单质反应的难易程度来比较元素的非金属性强弱
科目:高中化学 来源: 题型:
【题目】25°C时,某化学实验小组同学向用大理石和稀盐酸制备CO2后的残留液中滴加碳酸钠溶液,在溶液中插入pH传感器,测得pH变化曲线如图所示.下列说法不正确的是( ) 
A.开始时溶液pH=2是因为残留液中还有盐酸剩余
B.BC段表示随着碳酸钠溶液的滴入,CaCO3沉淀的质量逐渐增加
C.滴入500滴碳酸钠溶液后溶液中c(OH﹣)>c(H+)
D.AB发生的反应为:Ca2++CO32﹣═CaCO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过下述流程回收Na2Cr2O7等物质. 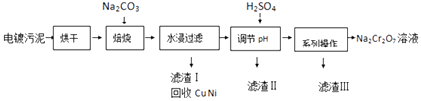
已知:
①Cr(OH)3、ZnO和Al2O3一样均为两性化合物;
②Na2Cr2O7、Na2SO4在不同温度下的溶解度如表:
20℃ | 60℃ | 100℃ | |
Na2SO4 | 19.5 | 45.3 | 42.5 |
Na2Cr2O7 | 183 | 269 | 415 |
(1)焙烧过程中生成Na2CrO4的化学方程式为;水浸后溶液中除Na2CrO4还存在的溶质有和;
(2)加入H2SO4调节pH的目的为;
(3)得到滤渣Ⅲ的“系列操作”的步骤为、过滤;
(4)若1L加入H2SO4后所得溶液中含铬元素质量为23.4g,CrO42﹣有8/9转化为Cr2O72﹣ , 求转化后所得溶液中c(Cr2O72﹣)=molL﹣1;
(5)向Na2Cr2O7与H2SO4混合液中加入H2O2 , 再加入乙醚并摇动,乙醚层为蓝色.乙醚中溶有CrO5 , 则发生反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,前者属于电解质,后者属于非电解质的是( )。
A. NaCl晶体、BaSO4 B. 铜、二氧化硫
C. 液态的醋酸、酒精 D. 熔融的KNO3.硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,前者属于电解质,后者属于非电解质的是( )。
A. NaCl晶体、BaSO4 B. 铜、二氧化硫
C. 液态的醋酸、酒精 D. 熔融的KNO3.硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.NA代表阿伏加德罗常数,1molC4H10中含共价键数目为14NA
B.某反应的△H=﹣88kJ?mol﹣1 , 则正反应活化能一定小于88kJ?mol﹣1
C.已知某温度下,Kw=l×10﹣13 , 若将pH=8的NaOH溶液与pH=5的H2SO4溶液混合保持温度不变,欲使混合溶液pH=7,则NaOH溶液与H2SO4溶液的体积比为11:9
D.将浓度为0.1 mol?L﹣1 HF溶液加水不断稀释过程中,电离度和Ka(HF)保持不变, ![]() 始终保持增大
始终保持增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和.
(1)A为 , B为 , C为 .
(2)E的电子式为 .
(3)写出D的最高价氧化物的水化物和A单质反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】龙胆酸烷基酯类F是一种药物皮肤美白剂,合成路线如下:

(1)D(龙胆酸)中含氧官能团的名称为 、 。
(2)E →F的反应类型是 。
(3)写出D →E反应的化学方程式: 。
(4)写出满足下列条件的龙胆酸乙酯( )的一种同分异构体结构简式: 。
)的一种同分异构体结构简式: 。
Ⅰ.能发生银镜反应,与FeCl3不发生显色反应但其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.核磁共振氢谱有四组峰,且峰的面积之比为6:2:1:1。
(5)已知: 。水杨酸乙酯(
。水杨酸乙酯( )广泛应用于日用香皂等。根据已有知识并结合相关信息,写出以苯、乙醇为原料制备水杨酸乙酯的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
)广泛应用于日用香皂等。根据已有知识并结合相关信息,写出以苯、乙醇为原料制备水杨酸乙酯的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用如图装置探究SO2和Fe(NO3)3溶液的反应:已知:1.0molL﹣1的Fe(NO3)3溶液的pH=1,请回答下列问题:
(1)滴加浓硫酸之前,先通氮气的目的是 , C装置的作用是 .
(2)充分反应后,能说明SO2和Fe(NO3)3溶液发生反应的实验现象是 .
(3)为探究SO2和Fe(NO3)3溶液发生反应的原理,该研究小组提出如下猜想:猜想1:SO2与Fe3+反应;
猜想2:在酸性条件下SO2与NO3﹣反应;
猜想3:
①若猜想1成立,装置B中反应的离子方程式是;若要检验Fe3+是否耗尽,所需试剂的化学式是 .
②若猜想2成立,还必须选用下列试剂中的(填字母)与SO2反应来进一步验证.
a.NaNO3与BaCl2的混合溶液
b.FeCl3 , NaNO3的混合溶液
c.FeCl3与BaCl2的混合溶液.
(4)SO2为空气污染物,研究小组为测定某工厂区空气中SO2的含量,取10m3(标准状况下)空气,缓慢通过足量溴水中,在所得溶液中加入过量的BaCl2溶液,将产生的白色沉淀洗涤、干燥,称得质量为0.4660g,则此空气中SO2的浓度为mgm﹣3 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com