
����Ŀ����������к���Cr��OH��3��Al2O3��ZnO��CuO��NiO�����ʣ���ҵ��ͨ���������̻���Na2Cr2O7�����ʣ� 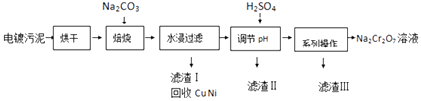
��֪��
��Cr��OH��3��ZnO��Al2O3һ����Ϊ���Ի����
��Na2Cr2O7��Na2SO4�ڲ�ͬ�¶��µ��ܽ�������
20�� | 60�� | 100�� | |
Na2SO4 | 19.5 | 45.3 | 42.5 |
Na2Cr2O7 | 183 | 269 | 415 |
��1�����չ���������Na2CrO4�Ļ�ѧ����ʽΪ��ˮ������Һ�г�Na2CrO4�����ڵ�����������
��2������H2SO4����pH��Ŀ��Ϊ��
��3���õ�������ġ�ϵ�в������IJ���Ϊ�����ˣ�
��4����1L����H2SO4��������Һ�к���Ԫ������Ϊ23.4g��CrO42����8/9ת��ΪCr2O72�� �� ��ת����������Һ��c��Cr2O72����=molL��1��
��5����Na2Cr2O7��H2SO4���Һ�м���H2O2 �� �ټ������Ѳ�ҡ�������Ѳ�Ϊ��ɫ������������CrO5 �� ������Ӧ�Ļ�ѧ����ʽΪ ��
���𰸡�
��1��4Cr��OH��3+4Na2CO3+3O2 ![]() 4Na2CrO4+6H2O+4CO2��NaAlO2��Na2ZnO2
4Na2CrO4+6H2O+4CO2��NaAlO2��Na2ZnO2
��2����ȥ��Һ��NaAlO2��Na2ZnO2���ʣ�����CrO42��ת��ΪCr2O72��
��3������Ũ������ȴ�ᾧ
��4��0.2
��5��Na2Cr2O7+4H2O2+H2SO4�T2CrO5+Na2SO4+5H2O
���������⣺��1����������ķ�����֪������������̼�����������������±������ɸ����ƣ���Ӧ�Ļ�ѧ����ʽΪ4Cr��OH��3+4Na2CO3+3O2 ![]() 4Na2CrO4+6H2O+4CO2 �� ���պ�Ĺ�����Na2CrO4��Na2ZnO2��NaAlO2������ˮ������ˮ������Һ�е����ʳ�Na2CrO4������ NaAlO2��Na2ZnO2 �� ���Դ��ǣ�4Cr��OH��3+4Na2CO3+3O2
4Na2CrO4+6H2O+4CO2 �� ���պ�Ĺ�����Na2CrO4��Na2ZnO2��NaAlO2������ˮ������ˮ������Һ�е����ʳ�Na2CrO4������ NaAlO2��Na2ZnO2 �� ���Դ��ǣ�4Cr��OH��3+4Na2CO3+3O2 ![]() 4Na2CrO4+6H2O+4CO2�� NaAlO2��Na2ZnO2����2��ˮ������Һ�д���Na2CrO4 �� �������ᷢ��CrO42��+2H+Cr2O72��+H2O��NaAlO2��Na2ZnO2���ᷴӦ�����Գ�ȥ��Һ��NaAlO2��Na2ZnO2���ʣ�����CrO42��ת��ΪCr2O72�� ��
4Na2CrO4+6H2O+4CO2�� NaAlO2��Na2ZnO2����2��ˮ������Һ�д���Na2CrO4 �� �������ᷢ��CrO42��+2H+Cr2O72��+H2O��NaAlO2��Na2ZnO2���ᷴӦ�����Գ�ȥ��Һ��NaAlO2��Na2ZnO2���ʣ�����CrO42��ת��ΪCr2O72�� ��
���Դ��ǣ���ȥ��Һ��NaAlO2��Na2ZnO2���ʣ�����CrO42��ת��ΪCr2O72������3���������м������������ظ����ƺ������ƣ����Եõ�������ӦΪ�����ƣ������������ʵ��ܽ�����¶ȵĹ�ϵ��֪�ظ����Ƶ��ܽ�Ƚϴ������Ƶ��ܽ�Ƚ�С�����Եõ������������ƵIJ���Ϊ ����Ũ������ȴ�ᾧ�����ˣ�
���Դ��ǣ�����Ũ������ȴ�ᾧ����4����1L����H2SO4��������Һ�к���Ԫ������Ϊ23.4g���������ʵ���Ϊ ![]() =0.45mol��CrO42����8/9ת��ΪCr2O72�� �� ������Һ��n��Cr2O72����=0.45mol��
=0.45mol��CrO42����8/9ת��ΪCr2O72�� �� ������Һ��n��Cr2O72����=0.45mol�� ![]() =��
=�� ![]() 0.2 mol������Һ��c��Cr2O72����=0.2molL��1 ��
0.2 mol������Һ��c��Cr2O72����=0.2molL��1 ��
���Դ��ǣ�0.2����5��Na2Cr2O7��H2O2 �� �����������·�Ӧ����CrO5 �� ��Ӧ�Ļ�ѧ����ʽΪNa2Cr2O7+4H2O2+H2SO4�T2CrO5+Na2SO4+5H2O��
���Դ��ǣ�Na2Cr2O7+4H2O2+H2SO4�T2CrO5+Na2SO4+5H2O��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ��������ˮϡ��1 mol��L��1��ˮ��0.01 mol��L��1������Һ��ϡ�ͣ����и�����ʼ�ձ����������Ƶ���(����)
A. ![]() B.
B. ![]() C.
C. ![]() D. c(OH��)
D. c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ��һ������Ũ���ᷴӦ���õ�����ͭ��Һ��NO2��NO�Ļ������2.24L����״��������Щ������һ�����O2����״������Ϻ�ͨ��ˮ�У�����������ȫ��ˮ�����������ᣮ������������ͭ��Һ�м���4molL��1NaOH��Һ��Cu2+ǡ����ȫ������������NaOH��Һ�������50mL������˵����ȷ���ǣ� ��
A.�μӷ�Ӧ��������0.4mol
B.�������������Ϊ1.68 L
C.�˷�Ӧ������ת�Ƶĵ���Ϊ0.3 mol
D.��������к�NO21.12 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Һ�壺���Ȼ�����Һ�����Ȼ�̼��ɵĻ��Һ ��43�����Ҵ���Һ �ۺ��������ˮ��Һ �ܴ�����Һ�л�����ɳ���������ϸ����Һ����ȷ����������
A. ��Һ����ȡ�����ᾧ B. ��ȡ������Һ���ᾧ
C. ������ȡ����Һ������ D. ��Һ��������ȡ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£��ڹ̶��ݻ����ܱ������У����淴ӦA(g)+3B(g) ![]() 2C(g)�ﵽƽ��ʱ�������ʵ����ʵ���֮��Ϊn(A)��n(B)��n(C)=2��2��1�������¶Ȳ��䣬��2��2��1�����ʵ���֮���ٳ���A��B��C���� �� ��
2C(g)�ﵽƽ��ʱ�������ʵ����ʵ���֮��Ϊn(A)��n(B)��n(C)=2��2��1�������¶Ȳ��䣬��2��2��1�����ʵ���֮���ٳ���A��B��C���� �� ��
A. ƽ�ⲻ�ƶ�
B. �ٴ�ƽ��ʱ��n(A)��n(B)��n(C)��Ϊ2��2��1
C. �ٴ�ƽ��ʱ��C�������������
D. �ٴ�ƽ��ʱ������Ӧ���������淴Ӧ���ʼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮú��������һ����Ҫ��ȼ�ϣ�Ҳ�Ǻϳɰ�����Ҫԭ������
��1����֪CO��H2ȼ�վ�Ϊ���ȷ�Ӧ��
����ͼ����ȷ��ʾ��Ӧ�������仯������ѡ�ͼA����ͼB������
��ˮú��ȼ�ϵ���У�ͨCO��H2�ļ�Ϊ��ص�����ѡ�������������
��2��ˮú���任��ӦΪ��CO��g��+H2O��g��CO2��g��+H2��g����H��0���ų������������д�ʩ����߷�Ӧ���ʵ�����������ţ�
a�������¶� b��������� c������ѹǿ d������Ũ��
�ڷ�Ӧ������H2�����ڹ�ҵ�ϳɰ�������֪��1mol H��H����1molN��N���ֱ���Ҫ���յ�����Ϊ436kJ��946kJ���γ�1molN��H����ų�����391kJ�����ڷ�ӦN2+3H2�T2NH3�У�ÿ����2molNH3����ա��ų���������kJ��������ͬ���������������г���1molN2��3molH2ʱ�����Ƿ�Ӧ��Ӧ������������ڡ��������ڡ���С�ڡ��������������ֵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮú��������һ����Ҫ��ȼ�ϣ�Ҳ�Ǻϳɰ�����Ҫԭ������
��1����֪CO��H2ȼ�վ�Ϊ���ȷ�Ӧ��
����ͼ����ȷ��ʾ��Ӧ�������仯������ѡ�ͼA����ͼB������
��ˮú��ȼ�ϵ���У�ͨCO��H2�ļ�Ϊ��ص�����ѡ�������������
��2��ˮú���任��ӦΪ��CO��g��+H2O��g��CO2��g��+H2��g����H��0���ų������������д�ʩ����߷�Ӧ���ʵ�����������ţ�
a�������¶� b��������� c������ѹǿ d������Ũ��
�ڷ�Ӧ������H2�����ڹ�ҵ�ϳɰ�������֪��1mol H��H����1molN��N���ֱ���Ҫ���յ�����Ϊ436kJ��946kJ���γ�1molN��H����ų�����391kJ�����ڷ�ӦN2+3H2�T2NH3�У�ÿ����2molNH3����ա��ų���������kJ��������ͬ���������������г���1molN2��3molH2ʱ�����Ƿ�Ӧ��Ӧ������������ڡ��������ڡ���С�ڡ��������������ֵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڵ���ʽ���ֶ�������ͼ������Ԫ�����ڱ���һ���֣��Ա���ѧ����Ԫ�����ڱ���������Ԫ�ص������ɣ��ж�����˵����ȷ���ǣ� �� 
A.��Ԫ���γɵĵ��ʾ��������ԭ�Ӿ���
B.��Ԫ�ص���̬�⻯����Һ��������Ϊ����Ӽ�������
C.�ڡ��ߡ����Ӧ�ļ����Ӱ뾶���μ�С
D.ʵ���ҿɸ��ݢޡ��ߵ��ʷֱ���ݵ��ʷ�Ӧ�����׳̶����Ƚ�Ԫ�صķǽ�����ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Dz��ܷ����ķ�Ӧ�ǣ� ��
A. ˮ�ⷴӦ B. ������Ӧ C. ������Ӧ D. ������Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com