
【题目】如图每一方框表示有关反应的某一反应物或生成物,有关操作已略去。又知A为高熔点物质,B为无色气体,D为一种天然出产的矿石的主要成分,可作为颜料。试回答:
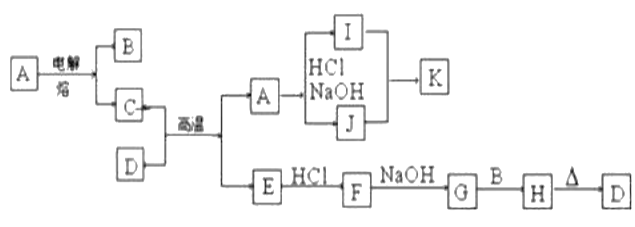
(1)写出下列物质的化学式:I____________,F____________。
(2)G转化为H的现象是____________,对应化学方程式为____________。
(3)写出I和J反应生成K的离子方程式____________。
(4)写出C+D→A+E的化学方程式________________________。
【答案】AlCl3 FeCl2 沉淀由白色迅速变成灰绿最后变成红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 3AlO2-+Al3++6H2O=4Al(OH)3 2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
【解析】
A能与盐酸、氢氧化钠反应,为两性物质,且为高熔点物质,A为两性氧化物Al2O3,I为AlCl3,J为NaAlO2,K为Al(OH)3。电解氧化铝可生成O2和Al,则无色气体B为O2,C为Al,C和D在高温下发生反应,应为铝热反应,D为一种天然出产的矿石的主要成分,可作为颜料,则D为赤铁矿中的Fe2O3,E为Fe,F为FeCl2,G为Fe(OH)2,H为Fe(OH)3,结合相关物质的性质解答。
根据以上分析可知A为Al2O3,B为O2,C为Al,D为Fe2O3,E为Fe,F为FeCl2,G为Fe(OH)2,H为Fe(OH)3,I为AlCl3,J为NaAlO2,K为Al(OH)3。则
(1)I、F的化学式分别是AlCl3、FeCl2。
(2)氢氧化亚铁易被氧化,则G转化为H的现象是沉淀由白色迅速变成灰绿最后变成红褐色,对应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(3)氯化铝和偏铝酸钠反应生成氢氧化铝的离子方程式为3AlO2-+Al3++6H2O=4Al(OH)3。
(4)C+D→A+E属于铝热反应,反应的化学方程式为2Al+Fe2O3![]() 2Fe+Al2O3。
2Fe+Al2O3。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.SO2、CO2、SiO2中的S、C、Si均为sp3杂化
B.H3O+、NH4+、[Cu(NH3)4]2+均含有配位键
C.SO32—、CO32—、SiO32—均为平面三角形
D.石墨、新型高分子导电材料、聚乙烯、金属晶体均含有金属键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组以SO2为原料,采用电化学方法制取硫酸。
(1)原电池原理:该小组设计的原理示意图如左下图,写出该电池负极的电极反应式______。
(2)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如右下图,写出开始电解时阳极的电极反应式________________。
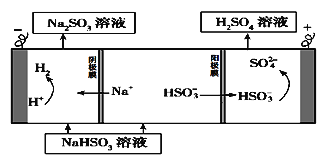
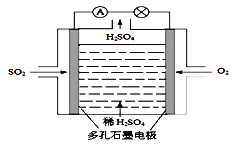
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 只含离子键的化合物才是离子晶体
B. (NH4)2SO4晶体是含有离子键、极性共价键和配位键的晶体
C. 由于I—I中的共价键键能比F—F、Cl—Cl、Br—Br都弱,因此在卤素单质中I2的熔点、沸点最低
D. 液态氯化氢能导电,说明氯化氢不是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1molL-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图 所示。下列判断正确的是
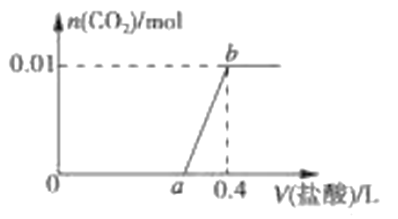
A. 在0a范围内,只发生NaOH和HCl的反应
B. ab段发生反应的离子方程式为:CO32-+2H+=CO2↑+H2O
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,正确的是
A.稀释浓H2SO4时,将蒸馏水沿容器内壁缓慢倒入浓H2SO中,并及时搅拌
B.测定溶液pH时,用洁净的玻璃棒蘸取待测液点在pH试纸上,观察试纸的颜色变化,并与标准比色卡相比较
C.称量NaOH固体时,将NaOH固体放在垫有滤纸的托盘上
D.在蒸发NaCl溶液得到NaCl晶体的实验中,必须待蒸发皿中的水分全部蒸干后才能撤去酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置如下图所示。下列说法正确的是( )

A. 燃料电池工作时,正极反应为:O2+ 2H2O + 4e-= 4OH-
B. 若a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C. 若a、b极都是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等
D. 若a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下含碳各微粒H2CO3、HCO3-和CO32-存在于CO2和NaOH溶液反应后的溶液中,它们的物质的量分数与溶液pH的关系如图所示,下列说法错误的是( )

A. 为获得尽可能纯的NaHCO3,宜控制溶液的pH为7~9之间
B. pH=10.25时,c(Na+)=c(CO32-)+c(HCO3-)
C. 根据图中数据,可以计算得到H2CO3第一步电离的平衡常数K1(H2CO3)=10-6.37
D. 若是0.1mol NaOH反应后所得的1L溶液,pH=10时,溶液中存在以下关系: c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,能长时间保持稳定的放电电压。其电池总反应为:3Zn + 2K2FeO4 + 8H2O![]() 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是
A. 放电时负极反应为:Zn-2e-+2OH-= Zn(OH)2
B. 充电时阳极发生氧化反应,附近溶液碱性增强
C. 充电时每转移3mol电子,阴极有1.5molZn生成
D. 放电时正极反应为:FeO42- + 3e- + 4H2O = Fe(OH)3 + 5OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com