
【题目】某学习小组以SO2为原料,采用电化学方法制取硫酸。
(1)原电池原理:该小组设计的原理示意图如左下图,写出该电池负极的电极反应式______。
(2)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如右下图,写出开始电解时阳极的电极反应式________________。
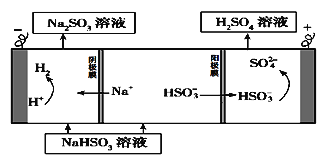
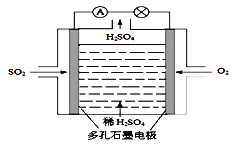
【答案】 SO2-2e-+2H2O=SO42-+4H+ HSO3--2e-+H2O= SO42-+3H+
【解析】试题分析:(1)原电池总反应为2SO2+ O2+2H2O= 2H2SO4,原电池负极失电子发生氧化反应,正极得电子发生还原反应;(2)NaHSO3溶液电解生成硫酸,硫元素化合价升高发生氧化反应;
解析:(1) 该电池中SO2失电子发生氧化反应,所以该电池负极的电极反应式SO2-2e-+2H2O=SO42-+4H+;(2) NaHSO3溶液电解生成硫酸,硫元素化合价升高发生氧化反应,电解池阳极HSO3-失电子发生氧化反应,所以阳极的电极反应式HSO3--2e-+H2O= SO42-+3H+。


科目:高中化学 来源: 题型:
【题目】以0.100 0 mol·L-1 NaOH溶液滴定c mol·L-1某弱酸HA溶液,其滴定曲线如图所示。下列说法正确的是
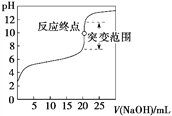
A. 可用甲基橙作滴定指示剂(已知甲基橙的变色范围为3.1~4.4,pH<3.1时溶液为红色,pH>4.4时溶液为黄色)
B. 指示剂指示的滴定终点就是反应终点
C. 突变范围的大小与酸的强弱及酸的浓度有关
D. 滴定时氢氧化钠溶液盛放在带活塞的滴定管中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行SO2的性质实验。在点滴板a、b、c处分别滴有不同的试剂,再向Na2SO3固体上滴加数滴浓H2SO4后,在整个点滴板上盖上培养皿,一段时间后观察到的实验现象如下表所示。
序号 | 试剂 | 实验现象 |
|
a | 品红溶液 | 红色褪去 | |
b | 酸性KMnO4溶液 | 紫色褪去 | |
c | NaOH溶液(含2滴酚酞) | 红色褪去 |
下列说法正确的是
A. 浓硫酸与Na2SO3固体发生了氧化还原反应
B. a、b均表明SO2具有漂白性
C. c中只可能发生反应:SO2+ 2OH—= SO32—+ H2O
D. c中所得溶液的离子浓度一定存在关系:c(Na+)+c(H+) = 2c(SO32—) +c(HSO3) + c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 100mL12mol/L的浓硝酸与过量Cu反应转移电子数目为0.6NA
B. 将1molCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA
C. 同温同压下,两个等体积的干燥圆底烧瓶中分别充满①HCl ②NO2 ,进行喷泉实验。经充分反应后烧瓶内溶质的物质的量浓度之比为3:2
D. 实验室里要用480 mL 0.1mol/L的硫酸铜溶液,需称取12.5克胆矾配制成溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明的溶液中,能大量共存的离子组是
A.Na+、Mg2+、H+、OH-B.H+、Al3+、AlO2-、CO32-
C.H+、Fe3+、Cl-、SiO32-D.K+、Ca2+、NO3-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不可能通过一步反应直接完成的是
A. Al(OH)3 → Al2O3 B. Al2O3 → Al(OH)3
C. Al → AlO2- D. Al3+ → Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图每一方框表示有关反应的某一反应物或生成物,有关操作已略去。又知A为高熔点物质,B为无色气体,D为一种天然出产的矿石的主要成分,可作为颜料。试回答:
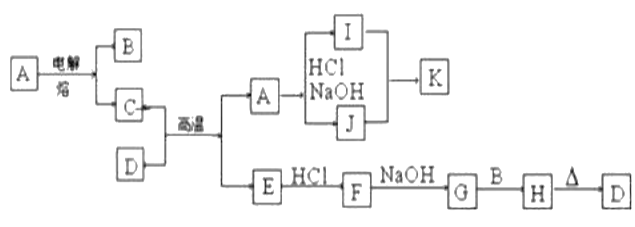
(1)写出下列物质的化学式:I____________,F____________。
(2)G转化为H的现象是____________,对应化学方程式为____________。
(3)写出I和J反应生成K的离子方程式____________。
(4)写出C+D→A+E的化学方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素。回答下列问题:
(1)甲能形成多种常见单质,在熔点很高的两种常见单质中,原子的杂化方式分别为______、__________。
(2)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测丁元素的电离能突增应出现在第________电离能。
(3)戊的基态原子有________种形状不同的原子轨道;
(4)甲、乙分别都能与丙形成原子个数比为 1:3的微粒,则该两种微粒的空间构型分别为:_________________ ;__________________。
(5)丙和丁形成的一种离子化合物的晶胞结构如右图,该晶体中阳离子的配位数为_________ 。距一个阴离子周围最近的所有阳离子为顶点构成的几何体为_______________。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,该化合物的相对分子质量为 M,则该晶胞中黑球的半径r =_____cm。(用含ρ、NA的计算式表示)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com