
【题目】在无色透明的溶液中,能大量共存的离子组是
A.Na+、Mg2+、H+、OH-B.H+、Al3+、AlO2-、CO32-
C.H+、Fe3+、Cl-、SiO32-D.K+、Ca2+、NO3-、HCO3-
科目:高中化学 来源: 题型:
【题目】实验室常利用以下反应制取少量氮气:NaNO2+NH4Cl![]() NaCl+N2↑+2H2O;关于该反应的下列说法不正确的是( )
NaCl+N2↑+2H2O;关于该反应的下列说法不正确的是( )
A. Na2NO2是氧化剂,NH4Cl是原剂
B. N2既是氧化产物,又是还原产物
C. NH4Cl中氮元素被还原
D. 每生成1molN2转移电子的物质的量为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国重离子研究中心2010年2月19日宣布,由该中心人工合成的第ll2号化学元素从即日起获正式名称“Copemicium”,相应的元素符号为“Cn”。该元素的名称是为了纪念著名天文学家哥白尼而得名。该中心人工合成Cn的过程可表示为:7030Zn+20882Pb→277112Cn+10n。下列叙述中正确的是 ( )
A. 上述合成过程属于化学变化
B. Cn元素位于元素周期表的第七周期,是副族元素
C. Cn元素的相对原子质量为277
D. 277112Cn的原子核内质子数比中子数多53
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由金红石(TiO2)制取单质Ti的反应步骤为:![]()
已知:①C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
③TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH=+141 kJ·mol-1
则④TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH为( )
A. —160 kJ·mol-1 B. +160 kJ·mol-1
C. -80 kJ·mol-1 D. +80 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组以SO2为原料,采用电化学方法制取硫酸。
(1)原电池原理:该小组设计的原理示意图如左下图,写出该电池负极的电极反应式______。
(2)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如右下图,写出开始电解时阳极的电极反应式________________。
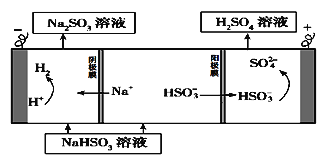
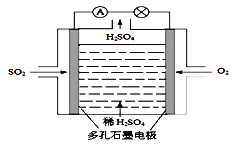
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了一个甲醇(CH3OH)燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如图1:
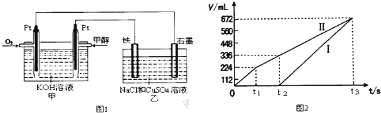
(1)25℃,1.01×105Pa时16g液态甲醇完全燃烧,当恢复至原状态时,放出362.9kJ热量,此反应的热化学方程式为 。
(2)写出甲中通入甲醇这一极的电极反应式 。
(3)铁电极上反应的现象为:先有红色的物质析出,后 。
石墨电极上产生的气体是 。
(4)理论上乙中两极所得气体的体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积)原混合溶液中CuSO4的物质的量浓度 mol·L-1。(假设溶液体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1molL-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图 所示。下列判断正确的是
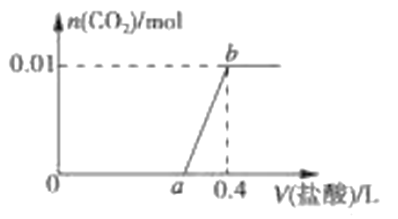
A. 在0a范围内,只发生NaOH和HCl的反应
B. ab段发生反应的离子方程式为:CO32-+2H+=CO2↑+H2O
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用;锂元素更是被誉为“能源元素”。
Ⅰ、锂的原子结构示意图为___________;锂在空气中燃烧,发出浅蓝色的火焰,放出浓厚的白烟,生成相应氧化物____________(填化学式)。
Ⅱ、锂经常用于制作电池。锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。回答下列问题:
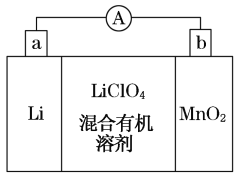
(1)外电路的电流方向是由________极流向________极。(填字母)
(2)电池正极反应式____________________________________。
(3)是否可用水代替电池中的混合有机溶剂?________(填“是”或“否”),用化学反应方程式解释原因______________________________________________。
Ⅲ、下面是从锂辉石(Li2O·Al2O3·SiO2)中提取锂的工业流程示意图。
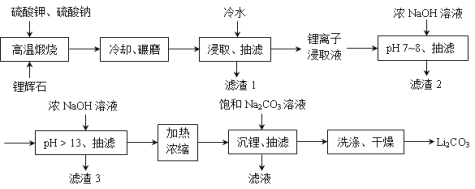
① 高温煅烧时的反应原理为:Li2OAl2O3SiO2+K2SO4= K2OAl2O3SiO2+Li2SO4;
Li2OAl2O3SiO2+Na2SO4= Na2OAl2O3SiO2+Li2SO4。
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+ 。
③几种金属离子沉淀完全的pH
金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
④Li2SO4、Li2CO3在不同温度下的溶解度(g / 100g水)
温度 溶解度 | 10 | 20 | 50 | 80 |
Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
(1)浸取时使用冷水的原因是______________________________________。
(2)滤渣2的主要成分为__________________。
(3)流程中分2次调节pH(pH7~8和pH > 13),有研究者尝试只加一次浓NaOH溶液使pH > 13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多。Li2CO3产品中的杂质可能是__________________,用离子方程式表示其产生的原因_____________________________。
(4)洗涤Li2CO3晶体使用_____________。(填“冷水”或“热水”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com