
【题目】据报道,我国化学研究人员用Ni(NO3)2和Tb(CH3COO)3等合成了一个镍的一维链状配位聚合物(如图),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。

请回答下列问题:
(1)基态Ni原子的价电子轨道表达式为____________,Ni在元素周期表中处于第____________纵行。
(2)C、N、O三种元素中电负性最大的是____(填元素符号),C在形成化合物时,其键型以共价键为主,原因是_____________。
(3)Ni(NO3)2中阴离子的空间构型是______,写出与该阴离子互为等电子体的一种分子的化学式:________。
(4)一维链状配位聚合物中,碳原子的杂化形式为________________________。
(5)已知: CH3COOH的沸点为117.9℃, HCOOCH3的沸点为32℃,CH3COOH的沸点高于 HCOOCH3的主要原因是______。
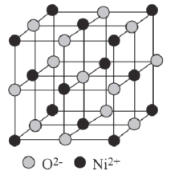
(6)已知:氧化镍的晶胞结构如图所示。
①若NA为阿伏加德罗常数的值,晶体密度为ρg·cm-3,则该晶胞中最近的O2-之间的距离为____pm(用含ρ、NA的代数式表示)。
②某缺陷氧化镍的组成为 Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为___。
【答案】![]() 10 O C有4个价电子且半径较小,难以通过得到或失去电子达到稳定结构 平面三角形 SO3(或BF3)(合理即可) sp2、sp3 CH3COOH分子间存在氢键,而HCOOCH3分子之间没有氢键
10 O C有4个价电子且半径较小,难以通过得到或失去电子达到稳定结构 平面三角形 SO3(或BF3)(合理即可) sp2、sp3 CH3COOH分子间存在氢键,而HCOOCH3分子之间没有氢键 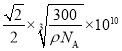 91:6
91:6
【解析】
(1)Ni的原子序数为28,根据构造原理写其价电子轨道表达式;
(2)同周期元素从左至右,电负性依次增强;根据碳原子的原子结构特点分析其成键特点;
(3)根据价层电子对互斥理论分析离子构型;互为等电子体的分子或离子的价电子总数和原子总数均相等;
(4)根据杂化轨道理论分析碳原子的杂化方式;
(5)根据氢键对物质性质的影响分析;
(6)①根据均摊法,确定晶胞中离子个数,进而计算晶胞的质量,再计算晶胞的边长,再根据几何关系计算最近的O2-之间的距离;
②根据守恒思想和化合价代数和为0计算。
(1)Ni的原子序数为28,在元素周期表中处于第10纵行,根据构造原理可写出其价电子轨道表达式为![]() ,故答案为:
,故答案为:![]() ;10;
;10;
(2)同周期元素从左至右,电负性依次增强,则C、N、O三种元素中电负性最大的是O元素,由于C有4个价电子且半径较小,难以通过得到或失去电子达到稳定结构,所以C在形成化合物时,其键型以共价键为主,故答案为:O;C有4个价电子且半径较小,难以通过得到或失去电子达到稳定结构;
(3)Ni(NO3)2的阴离子为NO3-,中心原子N原子的σ键电子对数为3,孤电子对数= ![]() ,则N原子的价层电子对数为3,N原子采取sp2杂化,则其空间构型是平面三角形;SO3(或BF3)与其互为等电子体,它们的价电子总数和原子总数均相等,故答案为:平面三角形;SO3(或BF3)(合理即可);
,则N原子的价层电子对数为3,N原子采取sp2杂化,则其空间构型是平面三角形;SO3(或BF3)与其互为等电子体,它们的价电子总数和原子总数均相等,故答案为:平面三角形;SO3(或BF3)(合理即可);
(4)由一维链状配位聚合物的结构可知,其碳原子的σ键电子对数为分别为3、4,没有孤电子对,则碳原子的价层电子对数分别为3、4,则碳原子的杂化形式为sp2、sp3,故答案为:sp2、sp3;
(5)在CH3COOH中存在O-H键,因此分子之间可形成氢键,而HCOOCH3分子不具备形成氢键的条件,分子之间没有氢键,因此CH3COOH的沸点较高,故答案为:CH3COOH分子间存在氢键,而HCOOCH3分子之间没有氢键;
(6)①根据均摊法可知,晶胞中O2-的个数为![]() ,Ni2+的个数为
,Ni2+的个数为![]() ,则晶胞的质量为
,则晶胞的质量为![]() ,则晶胞的边长为
,则晶胞的边长为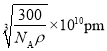 ,则该晶胞中最近的O2-之间的距离为
,则该晶胞中最近的O2-之间的距离为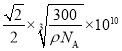 pm,故答案为:
pm,故答案为: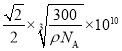 ;
;
②设Ni2+和Ni3+的个数分别为x、y,则可得方程组,x+y=0.97,2x+3y=2,x=0.91,y=0.06,则Ni2+和Ni3+的个数之比为0.91:0.06=91:6,故答案为:91:6。


科目:高中化学 来源: 题型:
【题目】从铜氨废液含[Cu(NH3)3·CO]+、[Cu(NH3)2]2+、[Cu(NH3)4]2+、NH3、CH3COO-、CO32-等中回收铜的工艺流程如图:

(1)步骤(Ⅰ)“吹脱”的目的是___(写一条即可);由步骤(Ⅱ)可确定NH3与H+的结合能力比与Cu2+的___(填“强”或“弱”)。
(2)步骤(Ⅲ)“沉铜”时,Na2S的用量比理论用量多,目的是___。
(3)步骤(Ⅳ)反应中,氧化产物与还原产物的物质的量之比为___。
(4)步骤(Ⅵ)发生反应生成难溶Cu2(OH)3Cl的离子方程式为___,pH与铜的回收率关系如图(a)所示,为尽可能提高铜的回收率,需控制的pH约为___。

(5)“吹脱”后的铜氨溶液中加入适量的添加剂可直接电解回收金属铜,装置如图(b)所示,阴极主要发生的电极方程式为___;添加NaCl和H2SO4均可提高电导率和电流效率,从而提高铜的回收率,从环境角度考虑,较好的是___(填“NaCl”或“H2SO4”)。
(6)已知上述流程中只有步骤(Ⅲ)“沉铜”和步骤Ⅴ“制硫酸铜”中铜元素有损耗。步骤(Ⅲ)“沉铜”时铜元素的损耗率为4%;步骤Ⅴ“制硫酸铜”时铜元素损耗率为2%。若1L废液最终制得CuSO45H2O375g,则1L废液中含有铜元素的质量为___g。(保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解下列溶液一段时间后再加入一定量的某种物质(方括号内物质),能够使溶液恢复到原来的成分和浓度的是( )
A. AgNO3 [AgNO3] B. NaOH [H2O]
C. KCl [KCl] D. CuSO4 [Cu(OH)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是的介色化学理的新型发电装置,下图为电池示意图,该电池电极表面镀一层细细的铂粉,吸附气体的能力强,性质稳定,请回答

(1)氢氧燃料电量的转化形式是____,在导线中电了的流动方向为______(用a,b表示)
(2)负极反应式为___________
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能,因此大量安全储氢是关键技术之一,金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
I .2Li+H2=2LiH; II. LiH+H2O=LiOH+H2↑
①反应I中的还原剂是______,反应II中的氧化剂是______
②由LiH与H2O作用,放出224L(标准状况)H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为____mol;将产生的电能用来电解饱和食盐水,产生的氢气体积(标准状况)为_____L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 化学平衡正向发生移动时,平衡常数K值一定增大
B. HS-的电离方程式:HS-+H2O![]() S2-+H3O+
S2-+H3O+
C. 由水电离出的c(H+)=1×10-13mol/L的溶液中,可能大量共存的离子:Fe3+、K+、NH4+、 SO42-、Cl-、ClO-
D. AlCl3溶液与Na2CO3溶液混合发生反应:2Al3++3CO32-=Al2(CO3)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化硼(BCl3)是一种重要的化工原料。实验室制备BCl3的原理B2O3+3C+3Cl2 =2BCl3+3CO,某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。已知:BCl3的熔点为-107.3℃,沸点为12.5℃,遇水水解生成H3BO3和HCl,请回答下列问题:
(实验Ⅰ)制备BCl3并验证产物CO

(1)该实验装置中合理的连接顺序为G→_____→_____→_____→____→F→D→I。其中装置E的作用是___________________________。
(2)装置J中反应的化学方程式为____________________________________。
(实验Ⅱ)产品中氯含量的测定
①准确称取少许m克产品,置于蒸馏水中完全水解,并配成100mL溶液。
②取10.00mL溶液于锥形瓶中
③加入V1mL浓度为C1 mol/LAgNO3溶液使氯离子完全沉淀;向其中加入少许硝基苯用力摇动。
④以硝酸铁为指示剂,用C2 mol/L KSCN标准溶液滴定过量的AgNO3溶液。发生反应:Ag+ +SCN- =AgSCN↓。
⑤重复步骤②~④二次,达到滴定终点时用去KSCN溶液的平均体积为V2 mL。
已知: Ksp(AgCl)>Ksp(AgSCN) 。
(3)步骤④中达到滴定终点的现象为__________________。
(4)实验过程中加入硝基苯的目的是___________________。
(5)产品中氯元素的质量分数为_________________%。
(6)下列操作,可能引起测得产品中氯含量偏高是__________。
A.步骤③中未加硝基苯
B.步骤①中配制100mL溶液时,定容时俯视刻度线
C.用KSCN溶液滴定剩余AgNO3溶液时,滴定前有气泡,滴定后无气泡
D.滴定剩余AgNO3溶液时,KSCN溶液滴到锥形瓶外面一滴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正硼酸(H3BO3)是一种片层状结构白色晶体,有与石墨相似的层状结构,受热易分解,层内的H3BO3分子通过氢键相连(如图所示),则下列有关说法中不正确的是
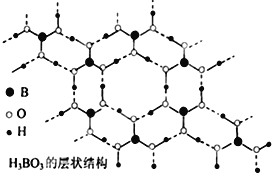
A. 正硼酸晶体属于分子晶体
B. 正硼酸分子的稳定性与氢键无关
C. 1molH3BO3晶体中含有3mol氢键
D. B原子杂化轨道的类型sp2,层间的H3BO3分子通过共价键相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某草药中有一种色素,它的结没食子儿茶素的结构简式如图,它是目前尚不能人工合成的纯天然、高效能的抗氧化剂.下列关于该物质的叙述正确的是( )
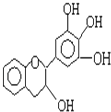
A.分子式为C15H12O5
B.1 mol 该物质与4mol NaOH恰好完全反应
C.该物质在浓硫酸作用下可发生消去反应
D.该物质可以和溴水发生取代反应和加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可充电锂空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是( )
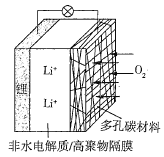
A.放电时,多孔碳材料电极为负极
B.放电时,外电路电子由多孔碳材料电极流向锂电极
C.放电时,电解质溶液中Li+向锂电极迁移
D.放电时,电池总反应为2Li+(1-![]() )O2=Li2O2-x
)O2=Li2O2-x
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com