
NA代表阿伏加德罗常数,下列叙述正确的是
A.1 mol Cl2在反应中得到电子数不一定为2NA
B.1 mol O2在反应中得到电子数一定为4 NA
C.1 mo1 Na2O2与足量H2O反应,转移了2 NA 个电子
D.在2KClO3+4HC1(浓)= =2KCl+2C1O2↑+C12↑+2H2O中,氯气既是氧化产物又是还原产物
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列除去杂质的方法正确的是 ( )
A 除去N2中的少量O2:通过灼热的CuO粉末,收集气体
B 除去CO2中的少量HCl:通入Na2CO3溶液,收集气体
C 除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
D 除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
下表各组物质之间通过一步反应不可以实现如右图所示转化关系的是
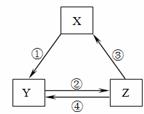
| 选项 | X | Y | Z | 箭头上所标 数字的反应条件 |
| A | Na2O2 | NaOH | NaCl | ① 常温遇水 |
| B | AlCl3 | NaAlO2 | Al(OH)3 | ② 通入CO2 |
| C | NO | NO2 | HNO3 | ④ 加入铜粉 |
| D | Cl2 | NaClO | HClO | ③ 加浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:
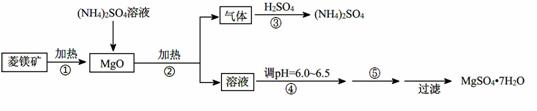 (1)步骤②中发生反应的离子方程式为 。
(1)步骤②中发生反应的离子方程式为 。
(2)步骤④中调节pH=6.0~6.5的目的是 。
(3)步骤⑤的操作为
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色
为 [25℃时,Ksp[Mg(OH)2] =5.6×10-12]。
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.02 mol Na别投入到盛有100 mL水、100 mL 1mol 盐酸、100 mL 1mol
盐酸、100 mL 1mol 硫酸铜溶液的X、Y、Z三个烧杯中,下列有关说法错误的是( )。
硫酸铜溶液的X、Y、Z三个烧杯中,下列有关说法错误的是( )。
A.三个烧杯中一定均会发生的离子反应有:2Na+2H2O==2Na++2OH—+H2↑
B.三个烧杯中钠均在液面上剧烈反应,相比而言,X烧杯中的反应平缓些
C.Z烧杯中一定会有沉淀生成,但沉淀不是单质铜
D.三个烧杯中生成氢气体的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列描述jE确的是
A.氯气、活性炭都能使品红溶液褪色,它们的漂白原理相同
B.滴加石蕊试液显红色的溶液:Fe3+、NH4+、I-可能大量共存
C.某溶液中加入盐酸酸化的氯化钡产生白色沉淀,原溶液中一定含有SO42-
D.Fe(NO3)2溶液中滴加少量稀硫酸会变黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是实验室中制备气体或验证气体性质的装置图

(1)写出用A制取氯气的化学方程式_________________________________________。
(2)利用上图装置制备纯净的氯气,并证明氧化性:Cl2>Fe3+
则装置B中的溶液的作用是___________________________________;
装置D中加的最佳试剂是(填序号)___________:
供选试剂:a.浓H2SO4 b.FeCl2溶液 c.KSCN与FeCl2的混合溶液 d.无水氯化钙
(3)在上图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置同时完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
证明SO2具氧化性和漂白性:B中为少量Na2S溶液、C中加品红溶液,D中应加入足量的__________(填溶液名称),E中加入___________溶液(填化学式)。
(4)证明碳元素的非金属性比硅元素的强的现象为______________________;
实验2不严谨之处应如何改进________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中对离子方程式书写的评价正确的是
| 选项 | 化学反应及离子方程式 | 评价 |
| A | 将铝粉加入含氢氧化钠溶液中: 2Na++2OH-+2Al+H2O=2Na++AlO2-+3H2↑ | 正确 |
| B | Na2O2与H2O反应: Na2O2+H2O===2Na++2OH-+O2↑ | 错误,氧元素不守恒 |
| C | 碳酸氢钠与醋酸反应: HCO3-+H+= H2O+CO2↑ | 正确 |
| D | 向FeCl3溶液中滴加足量氨水: Fe3++3OH-=== Fe(OH)3↓ | 正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。
(1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30%H2O2溶液、0.1 mol·L-1Fe2(SO4)3溶液、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:______________________________。
②设计实验方案:在不同H2O2浓度下,测定________(要求所测得的数据能直接体现反应速率大小)。
③设计实验装置,完成图中的装置示意图。
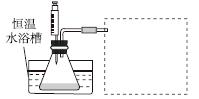
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。
| 物理量 实验序号 | V[0.1 mol·L-1 Fe2(SO4)3]/mL | …… | |
| 1 | a | …… | |
| 2 | a | …… |
(2)利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的__________(填“深”或“浅”),其原因是____________________________。
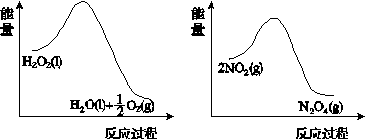
(a) (b)
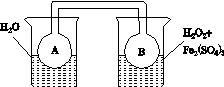
(c)
图21
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com