
【题目】下面是某校化学研究性学习小组探究的过量的Fe与浓硫酸反应的实验:
I.甲同学设计如下实验验证反应得到的混合气体中含有SO2、H2、H2O
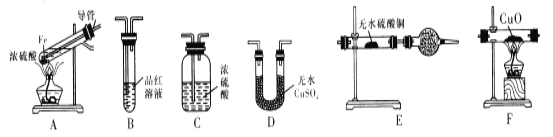
己知:CaSO3受热易分解
(1)写出过量Fe粉与浓硫酸反应产生等体积的SO2与H2的总化学方程式:________
(2)若按气体从左到右的流向,为达到实验目的,各装置连接顺序是A→___(不可重复使用)。
(3)装置E中的干燥管中盛放的物质为碱石灰,其作用是______。
(4)证明有H2存在的实验现象是_________。
II.为测定混合气体中SO2的体积分数,,乙同学设计了如下实验方案:
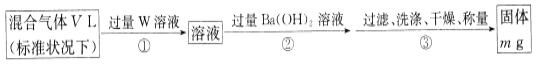
(5)W溶液可以是下列溶液中的______(填字母代号);
A.H2O2溶液 B.NaOH溶液 C.KMnO4溶液(硫酸酸化) D.氯水
该混合气体中二氧化硫的体积分数为___________(用含V、m的代数式表示)。
(6)丙同学使用cmol/LxmLI2的淀粉溶液(过量)吸收混合气体,充分反应后,用0.1000mol/L的Na2S2O3标准溶液去滴定I2的淀粉溶液,达到滴定终点时消耗Na2S2O3的体积为20mL,该混合气体中二氧化硫的体积分数为____ (用含V、c、x的代数式表示)[已知:I2+2S2O32-=2I-+S4O62-]。
【答案】2Fe+3H2SO4=2FeSO4+SO2↑+H2↑+2H2O D→B→C→F→E 防止空气中的水分干扰实验,吸收多余的SO2 F中黑色固体粉末变为红色,E中无水硫酸铜变蓝 AD 22.4m/233V 22.4×10-3(cx-1)/V
【解析】
(1)根据原子守恒可知过量Fe粉与浓硫酸反应产生等体积的SO2与H2的总化学方程式为2Fe+3H2SO4=2FeSO4+SO2↑+H2↑+2H2O。
(2)由于通过溶液会带出水蒸气,首先检验水蒸气,利用品红溶液检验SO2,氢气和氧化铜反应之前还需要干燥氢气,且SO2有毒、还需要防止空气中水蒸气进入,所以若按气体从左到右的流向,为达到实验目的,各装置连接顺序是A→D→B→C→F→E。
(3)反应中产生气体,因此A中导管的作用为安全管,平衡气压;装置E中的干燥管中盛放的物质为碱石灰,其作用是防止空气中的水分干扰实验,吸收多余的SO2。
(4)氢气还原氧化铜生成铜和氢气,则证明有H2存在的实验现象是F中黑色固体粉末变为红色,E中无水硫酸铜变蓝。
(5)由于亚硫酸钡不稳定,因此应该转化为硫酸钡,所以W应该具有氧化性,能把SO2氧化,且不能引入硫酸根,所以选择双氧水或氯水,答案选AD。
硫酸钡是mg,则根据硫原子守恒可知SO2是![]() ,所以该混合气体中二氧化硫的体积分数为
,所以该混合气体中二氧化硫的体积分数为 =
=![]() 。
。
(6)根据方程式I2+SO2+2H2O=H2SO4+2HI、I2+2S2O32-=2I-+S4O62-可知该混合气体中二氧化硫的体积分数为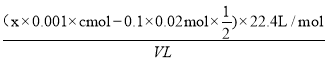 =
=![]() 。
。


科目:高中化学 来源: 题型:
【题目】某种降血压药物H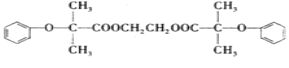 可由下列路线合成:
可由下列路线合成:
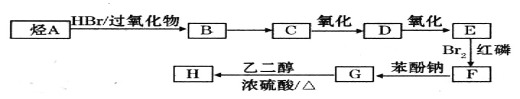
已知:
I.RCH=CH2 ![]() RCH2CH2Br
RCH2CH2Br
II.RCH2COOH![]()
回答下列问题:
(1)A的名称为______________。
(2)B→C的反应条件为_______________,E→F的反应类型为_______________。
(3)D结构简式为______________。
(4)与C同类别的同分异构体有_________种(不含C),其中核磁共振氢谱中面积比最大的是_________(写结构简式)。
(5)G→H的化学方程式为_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,已知Cu3P中P为-3价,则15molCuSO4可氧化的P的物质的量为
A. 1.5mol B. 5.5mol C. 3mol D. 2.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔为主要原料可以合成聚氯乙烯、聚丙烯腈和氯丁橡胶,如图所示是有关合成路线图.
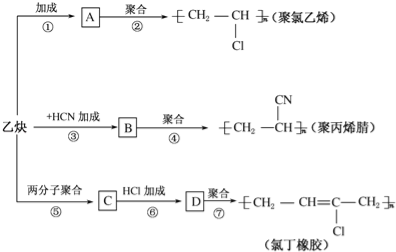
已知反应:nCH2═CH﹣CH═CH2![]()
![]()
请完成下列各题:
(1)写出物质的结构简式:A ,C .
(2)写出反应的化学方程式
反应②: ;
反应③: ;
反应⑥: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别用浓度均为0.5 mol/L的NH3·H2O和NaOH溶液,滴定20 mL 0.01 mol/L Al2(SO4)3溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是
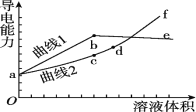
A. 曲线2 代表滴加NH3·H2O溶液的变化曲线
B. b和d点对应的溶液均显碱性
C. b点溶液中c(NH4+)>c(SO42-)>c(H+)>c(OH-)
D. d~f段导电能力升高的原因是发生了反应Al(OH)3+OH-===2H2O+AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3晶体,相应的实验流程如图所示。
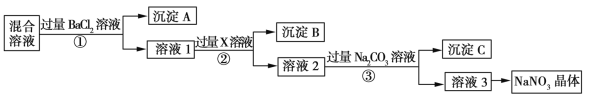
请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X__,沉淀A___。
(2)上述实验流程中①②③步均要进行的实验操作是__(填操作名称)。
(3)上述实验流程中加入过量Na2CO3溶液的目的是__________。
(4)按此实验方案得到的溶液3中肯定含有____(填化学式)杂质。为了解决这个问题,可以向溶液3中加入适量的__(填化学式)。
(5)在①步操作中如何证明加的BaCl2溶液已过量?________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol/L某一元酸(HA)溶液中c(H+)=1×10-3 mol/L,下列叙述正确的是( )
A. 该溶液中由水电离出的c(H+)=1×10-11 mol/L
B. 该一元酸溶液的pH=1
C. 该溶液中水电离的c(H+)=1×10-3 mol/L
D. 用pH=11的NaOH溶液V1 L和V2 L 0.1 mol/L该一元酸(HA)溶液混合,若恰好反应,则V1=V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,有![]() 盐酸;
盐酸;![]() 硫酸;
硫酸;![]() 醋酸三种酸的稀溶液
醋酸三种酸的稀溶液![]() 用a、b、c、
用a、b、c、![]() 、
、![]() 、
、![]() 号填写
号填写![]()
![]() 当其物质的量浓度相同时,
当其物质的量浓度相同时,![]() 由大到小的顺序是____________,
由大到小的顺序是____________,
![]() 同体积同物质的量浓度的三种酸,中和NaOH能力由大到小的顺序是____________,
同体积同物质的量浓度的三种酸,中和NaOH能力由大到小的顺序是____________,
![]() 当其
当其![]() 相同时,物质的量浓度由大到小的顺序为____________,
相同时,物质的量浓度由大到小的顺序为____________,
![]() 当
当![]() 相同、体积相同时,同时加入形状、质量、密度相同的锌,若产生相同体积的氢气
相同、体积相同时,同时加入形状、质量、密度相同的锌,若产生相同体积的氢气![]() 相同状况
相同状况![]() ,则开始时反应速率的大小关系是____________.
,则开始时反应速率的大小关系是____________.
![]() 将
将![]() 相同的三种酸均加水稀释至原来的10倍,
相同的三种酸均加水稀释至原来的10倍,![]() 由大到小的顺序为_____________.
由大到小的顺序为_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用电解法分开处理含有Cr2O72-及含有NO2-的酸性废水[最终Cr2O72-转化为Cr3+,NO2-转化为无毒物质],其装置如图所示。
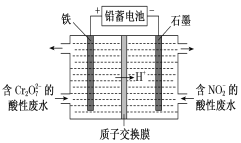
①阴极电极反应:________________________,
左池中Cr2O72-转化为Cr3+的离子方程式是_________________________________________。
②当阴极区消耗2 mol NO2-时,右池减少的H+的物质的量为________ mol。
③若将铁电极换成石墨棒,阳极电极反应式为:_________________________________。
(2)由甲醇(CH3OH)、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为___________________________________________,正极电极反应式_____________________________________________。
②若以该电池为电源,用石墨作电极电解200 mL含有2mol·L-1HCl与0.5mol·L-1CuSO4的混合溶液。当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的质量为_____g,总共转移_____mol电子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com