
【题目】分别用浓度均为0.5 mol/L的NH3·H2O和NaOH溶液,滴定20 mL 0.01 mol/L Al2(SO4)3溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是
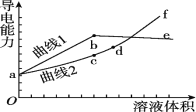
A. 曲线2 代表滴加NH3·H2O溶液的变化曲线
B. b和d点对应的溶液均显碱性
C. b点溶液中c(NH4+)>c(SO42-)>c(H+)>c(OH-)
D. d~f段导电能力升高的原因是发生了反应Al(OH)3+OH-===2H2O+AlO2-
【答案】C
【解析】
溶液中离子浓度越大,导电性越强;分别用浓度均为![]() 和NaOH溶液滴定
和NaOH溶液滴定![]() 溶液,一水合氨滴入发生反应:
溶液,一水合氨滴入发生反应:![]()
![]() ↓
↓![]() ,氢氧化钠溶液滴入发生的反应为:
,氢氧化钠溶液滴入发生的反应为:![]() ↓
↓![]() ,Al(OH)3+NaOH═2H2O+NaAlO2,所以曲线1为氨水滴入的反应,曲线2为氢氧化钠滴入的反应。
,Al(OH)3+NaOH═2H2O+NaAlO2,所以曲线1为氨水滴入的反应,曲线2为氢氧化钠滴入的反应。
A.一水合氨滴入发生反应: ![]()
![]() ↓
↓![]() ,氢氧化钠溶液滴入发生的反应为:
,氢氧化钠溶液滴入发生的反应为: ![]() ↓
↓![]() ,Al(OH)3+NaOH═2H2O+NaAlO2,所以曲线1为氨水滴入的反应,曲线2位氢氧化钠滴入的反应,故A错误;
,Al(OH)3+NaOH═2H2O+NaAlO2,所以曲线1为氨水滴入的反应,曲线2位氢氧化钠滴入的反应,故A错误;
B.b点为硫酸铵溶液,铵根水解溶液显酸性,d点是NaAlO2溶液,偏铝酸根离子水解溶液显碱性,故B错误;
C.b点为硫酸铵溶液,铵根水解溶液显酸性,溶液中离子浓度大小关系为![]() ,所以C选项是正确的;
,所以C选项是正确的;
D.d点是NaAlO2溶液,d点以后氢氧化钠过量,溶液中离子浓度增大,导电性增强,故D错误;
所以C选项是正确的。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入350mL 2molL﹣1的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A. 0.21 molB. 0.25 molC. 0.3 molD. 0.35 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数为NA,下列说法正确的是( )
A.1mol钠与足量氧气反应,生成氧化钠和过氧化钠的混合物,转移的电子数为NA
B.通常状况下,NA个CO2分子的体积是22.4L
C.100ml0.1mol/L的H2SO4溶液中H+的个数是0.2NA
D.若1gN2含有m个分子,则NA=m/28
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/L的NaOH溶液450ml。根据这种溶液的配制情况回答下列问题:
(1)在如图所示仪器中,配制上述溶液肯定不需要的是___(填序号),除图中已有仪器外,配制上述溶液还需要到的玻璃仪器是___。
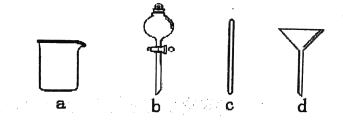
(2)配制时,其正确的操作顺序是(用字母表示,每个操作只用一次)___。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水稀释
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(3)实验两次用到玻璃棒,其作用分别是:先用于___、后用于___。
(4)关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是___
A.①②③④ B.②③ C.①②④ D.②③④
(5)根据计算用托盘天平称取的质量为___g。
II.若配制1mol/L的稀硫酸溶液500mL。
(6)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为:___mL(计算结果保留一位小数)。如果实验室有15mL、20mL、50mL量筒,应选用__mL的量筒最好。
(7)下列操作所造成硫酸浓度偏高的是___。
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视刻度线
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶中
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向某二元弱酸H2X的钠盐溶液中滴加盐酸,混合溶液中离子浓度与pH的关系如图所示,其中lgX =lgc(X2-)/ c(HX-) 或lgc(HX-)/c(H2X)。下列叙述不正确的是
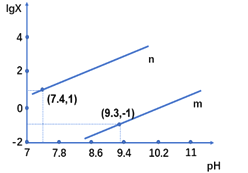
A. 当溶液呈中性时, c(HX-)>c(X2-)>c(H2X)
B. 曲线m表示lgc(X2-)/c(HX-)与pH的变化关系
C. Ka1(H2X)的数量级为10-7
D. 25℃时,NaHX溶液中:c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某校化学研究性学习小组探究的过量的Fe与浓硫酸反应的实验:
I.甲同学设计如下实验验证反应得到的混合气体中含有SO2、H2、H2O
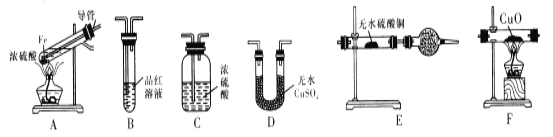
己知:CaSO3受热易分解
(1)写出过量Fe粉与浓硫酸反应产生等体积的SO2与H2的总化学方程式:________
(2)若按气体从左到右的流向,为达到实验目的,各装置连接顺序是A→___(不可重复使用)。
(3)装置E中的干燥管中盛放的物质为碱石灰,其作用是______。
(4)证明有H2存在的实验现象是_________。
II.为测定混合气体中SO2的体积分数,,乙同学设计了如下实验方案:
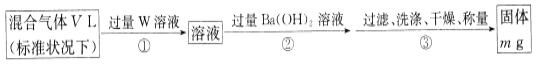
(5)W溶液可以是下列溶液中的______(填字母代号);
A.H2O2溶液 B.NaOH溶液 C.KMnO4溶液(硫酸酸化) D.氯水
该混合气体中二氧化硫的体积分数为___________(用含V、m的代数式表示)。
(6)丙同学使用cmol/LxmLI2的淀粉溶液(过量)吸收混合气体,充分反应后,用0.1000mol/L的Na2S2O3标准溶液去滴定I2的淀粉溶液,达到滴定终点时消耗Na2S2O3的体积为20mL,该混合气体中二氧化硫的体积分数为____ (用含V、c、x的代数式表示)[已知:I2+2S2O32-=2I-+S4O62-]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实或数据能说明次氯酸为弱电解质的是
A. 次氯酸具有漂白性 B. 常温时,次氯酸水溶液的pH < 7
C. 次氯酸不稳定,易分解 D. 0.001 molL-1 HClO溶液的pH = 5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生研究小组欲探究CuSO4溶液与Na2CO3溶液混合产生的蓝绿色沉淀组成,小组进行下列实验探究。
(提出假设)
假设1:沉淀为Cu(OH)2
假设2:沉淀为________
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3mCu(OH)2]
(查阅资料)无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
(物质成分探究)
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。
步骤2:甲同学取一定量固体,用气密性良好的下图装置(夹持仪器未画出)进行定性实验。请回答下列问题:
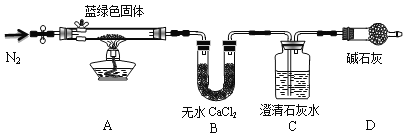
(1)假设2中的沉淀为________________。
(2)假设1中沉淀为Cu(OH)2的理论依据是____________________________________。
(3)无水乙醇洗涤的目的____________________________________________________。
(4)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设____(填写序号)成立。
(5)乙同学认为只要将上图中B装置的试剂改用_____________________试剂后,便可验证上述所有假设,装置D的作用是__________________________。
(6)乙同学更换B试剂后验证假设3成立的实验现象是_________________。
(7)在假设3成立的前提下,某同学考虑用Ba(OH)2溶液代替C中澄清石灰水,测定蓝绿色固体的化学式,若所取蓝绿色固体质量为27.1g,实验结束后装置B的质量增加2.7g,C中的产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列说法不正确的是

A. 反应CH4+H2O ![]() 3H2+CO,每消耗1mol CH4转移6mol e-
3H2+CO,每消耗1mol CH4转移6mol e-
B. 电池工作时,CO32-向电极A移动
C. 电极A上H2参与的电极反应为:H2-2e=2H+
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com