
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列说法不正确的是

A. 反应CH4+H2O ![]() 3H2+CO,每消耗1mol CH4转移6mol e-
3H2+CO,每消耗1mol CH4转移6mol e-
B. 电池工作时,CO32-向电极A移动
C. 电极A上H2参与的电极反应为:H2-2e=2H+
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
【答案】C
【解析】
甲烷和水经催化重整生成CO和H2,反应中C元素化合价由-4价升高到+2价,H元素化合价由+1价降低到0价,原电池工作时,CO和H2 在负极发生反应,被氧化生成二氧化碳和水,正极为氧气得电子生成CO32-,以此解答该题。
A.反应CH4+H2O ![]() 3H2+CO中,C元素化合价由-4价升高到+2价,H元素化合价由+1价降低到0价,每消耗1mol CH4转移6mol电子,A正确;
3H2+CO中,C元素化合价由-4价升高到+2价,H元素化合价由+1价降低到0价,每消耗1mol CH4转移6mol电子,A正确;
B.电池工作时,CO32-向负极移动,即向电极A移动,B正确;
C.电解质没有OH-,负极电极A上H2发生的反应为H2+CO32--2e-=H2O+CO2,C错误;
D.B为正极,正极为氧气得电子生成CO32-,反应为O2 +2CO2+4e- =2CO32-,D正确;
故合理选项是C。


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
【题目】分别用浓度均为0.5 mol/L的NH3·H2O和NaOH溶液,滴定20 mL 0.01 mol/L Al2(SO4)3溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是
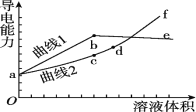
A. 曲线2 代表滴加NH3·H2O溶液的变化曲线
B. b和d点对应的溶液均显碱性
C. b点溶液中c(NH4+)>c(SO42-)>c(H+)>c(OH-)
D. d~f段导电能力升高的原因是发生了反应Al(OH)3+OH-===2H2O+AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬醛的结构简式如图所示,主要用作柠檬和什锦水果型香精,也是合成紫罗兰酮的主要原料

(1)柠檬醛不能发生的反应类型为_____________(填字母)。
A.酯化反应 B.加成反应 C.氧化反应 D.消去反应
(2)香叶醇经催化氧化可制得柠檬醛,则香叶醇的结构简式为_____________
(3)双羟基香茅酸(![]() 也是一种重要的香料,可由柠檬醛合成,合成路线如下
也是一种重要的香料,可由柠檬醛合成,合成路线如下

双羟基香茅酸的分子式为________,写出A→B的化学方程式___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是利用阴离子交换膜和过滤膜制备高纯度的Cu的装置示意图,下列有关叙述不正确的是
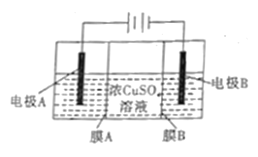
A. 电极A是粗铜,电极B是纯铜
B. 电路中通过1mol电子,生成32g铜
C. 溶液中SO42-向电极A迁移
D. 膜B是过滤膜,阻止阳极泥及杂质进入阴极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 、
、![]() 为不同的核素,化学性质也不同
为不同的核素,化学性质也不同
B. 乙醇和乙醚互为同分异构体
C. CH3CH(CH3)2的名称叫2-甲基丙烷,也可以叫做异丁烷
D. CH2=CH2和CH2=CH-CH=CH2具有相同的官能团,互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用电解法分开处理含有Cr2O72-及含有NO2-的酸性废水[最终Cr2O72-转化为Cr3+,NO2-转化为无毒物质],其装置如图所示。
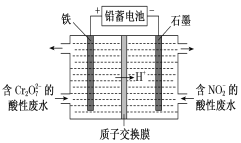
①阴极电极反应:________________________,
左池中Cr2O72-转化为Cr3+的离子方程式是_________________________________________。
②当阴极区消耗2 mol NO2-时,右池减少的H+的物质的量为________ mol。
③若将铁电极换成石墨棒,阳极电极反应式为:_________________________________。
(2)由甲醇(CH3OH)、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为___________________________________________,正极电极反应式_____________________________________________。
②若以该电池为电源,用石墨作电极电解200 mL含有2mol·L-1HCl与0.5mol·L-1CuSO4的混合溶液。当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的质量为_____g,总共转移_____mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. CS2分子的立体构型为V形
B. ClO3—的空间构型为平面三角形
C. SF6中有每个原子均满足最外层8电子稳定结构
D. SiF4和SO32—的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题(凡涉及的物质均用化学式表示):
(1)a的氢化物的分子构型为_________,中心原子的杂化形式为______;d的最高价氧化物分子构型为__________,中心原子的杂化形式为_______。
(2)g位于第________族,属于________区。写出其基态原子的电子排布式_____________________________。
(3)将f的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配离子,请写出生成此配离子的离子方程式:_______________________________________。
(4)CH3+、—CH3、CH3— 都是重要的有机反应中间体,有关它们的说法正确的是___________。
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH3—与NH3、H3O+互为等电子体,几何构型均为三角锥形
D.CH3+中的碳原子采取sp2杂化,所有原子均共面
E.两个—CH3或一个CH3+和一个CH3—结合均可得到CH3CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是
A.标准状况下,22.4LH2O水分子数为1NA
B.常温常压下,80gSO3含有的氧原子数为3NA
C.标准状况下,22.4L氦气中所含原子数为2NA
D.0.5mol/LFe2(SO4)3溶液中,SO42-的数目为1.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com