
【题目】如图是利用阴离子交换膜和过滤膜制备高纯度的Cu的装置示意图,下列有关叙述不正确的是
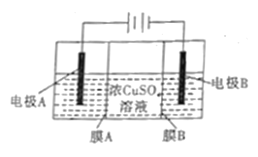
A. 电极A是粗铜,电极B是纯铜
B. 电路中通过1mol电子,生成32g铜
C. 溶液中SO42-向电极A迁移
D. 膜B是过滤膜,阻止阳极泥及杂质进入阴极区
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/L的NaOH溶液450ml。根据这种溶液的配制情况回答下列问题:
(1)在如图所示仪器中,配制上述溶液肯定不需要的是___(填序号),除图中已有仪器外,配制上述溶液还需要到的玻璃仪器是___。
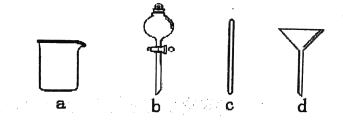
(2)配制时,其正确的操作顺序是(用字母表示,每个操作只用一次)___。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水稀释
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(3)实验两次用到玻璃棒,其作用分别是:先用于___、后用于___。
(4)关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是___
A.①②③④ B.②③ C.①②④ D.②③④
(5)根据计算用托盘天平称取的质量为___g。
II.若配制1mol/L的稀硫酸溶液500mL。
(6)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为:___mL(计算结果保留一位小数)。如果实验室有15mL、20mL、50mL量筒,应选用__mL的量筒最好。
(7)下列操作所造成硫酸浓度偏高的是___。
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视刻度线
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶中
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生研究小组欲探究CuSO4溶液与Na2CO3溶液混合产生的蓝绿色沉淀组成,小组进行下列实验探究。
(提出假设)
假设1:沉淀为Cu(OH)2
假设2:沉淀为________
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3mCu(OH)2]
(查阅资料)无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
(物质成分探究)
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。
步骤2:甲同学取一定量固体,用气密性良好的下图装置(夹持仪器未画出)进行定性实验。请回答下列问题:
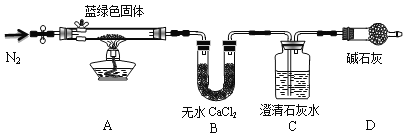
(1)假设2中的沉淀为________________。
(2)假设1中沉淀为Cu(OH)2的理论依据是____________________________________。
(3)无水乙醇洗涤的目的____________________________________________________。
(4)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设____(填写序号)成立。
(5)乙同学认为只要将上图中B装置的试剂改用_____________________试剂后,便可验证上述所有假设,装置D的作用是__________________________。
(6)乙同学更换B试剂后验证假设3成立的实验现象是_________________。
(7)在假设3成立的前提下,某同学考虑用Ba(OH)2溶液代替C中澄清石灰水,测定蓝绿色固体的化学式,若所取蓝绿色固体质量为27.1g,实验结束后装置B的质量增加2.7g,C中的产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化铝(AlON)具有多晶陶瓷在材料制备方面的优势,有着广阔的应用前景。工业上利用某铝土矿(含Al2O3及少量的MgO等杂质)生产氮氧化铝的流程如图所示。回答下列问题:
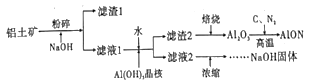
(1)为提高铝土矿碱浸的速率,除粉碎外,还可以采取的措施是_____(写出一项即可)
(2)滤液1的溶质有NaOH、_____。滤渣2的成分是_____。向滤液1中加水的目的是_______。该过程也可用通入足量的_____气体的方法来代替。
(3)滤液2浓缩的过程中常会吸收空气中的CO2,为得到纯净的NaOH,需要加入适量____(填化学式)。整个流程中,可循环的物质是_____。
(4)写出制备AlON的化学方程式_______。
(5)取1吨Al2O3质量分数为91.8%的铝土矿样品,利用上述流程AlON,最终制得氮氧化铝820.8kg,则氮氧化铝的产率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象或应用不能用胶体的知识解释的是( )
A.土壤表面积巨大且一般带负电,能吸收NH![]() 等营养离子,使土壤具有保肥能力
等营养离子,使土壤具有保肥能力
B.清晨,人们经常看到的阳光穿过茂密的树木枝叶所产生的美丽景象
C.水泥、冶金工厂常用高压电除去工厂烟尘,减少对空气的污染
D.向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H(![]() ),是一种常见的抗结肠炎药物。如图是利用芳香烃A为原料设计制备H的路线。
),是一种常见的抗结肠炎药物。如图是利用芳香烃A为原料设计制备H的路线。
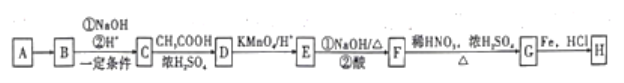
已知:①A蒸气的密度是相同条件下氢气密度的46倍;
②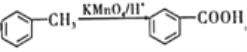 。
。
回答下列问题
(1)A的名称是_______,C中含有官能团的名称是____。
(2)写出C生成D的化学方程式:______,该反应的类型是______。
(3)G的结构简式是______。
(4)设计C→D和E→F两步反应的目的是______。
(5)化合物X是D的同分异构体,符合下列条件的X共______种。
①芳香族化合物,且苯环上有两个取代基②能发生水解反应
写出其中核磁共振氢谱显示有4种不同化学环境的氢原子,峰面积之比为3:3:2:2的所有X的结构简式:______。
(6)已知![]() 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻、对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料制备化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻、对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料制备化合物![]() 的合成路线(无机试剂任选)___________。
的合成路线(无机试剂任选)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列说法不正确的是

A. 反应CH4+H2O ![]() 3H2+CO,每消耗1mol CH4转移6mol e-
3H2+CO,每消耗1mol CH4转移6mol e-
B. 电池工作时,CO32-向电极A移动
C. 电极A上H2参与的电极反应为:H2-2e=2H+
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制,获得阻燃剂氢氧化镁。下列说法不正确的是

A. 步骤②中分离操作的名称是过滤,Mg(OH)2可以作阻燃剂是因为它分解需要吸收大量的热
B. 步骤①中的反应式:3Fe(OH)3 +S2O42-+2OH- =3Fe(OH)2 +2SO42-+4H2O
C. 步骤①中保险粉是作还原剂
D. 从步骤② 中可知OH- 和EDTA共存时,Fe2+更易和EDTA结合,生成可溶性化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某密闭容器中发生反应2HI(g)![]() H2(g)+I2(g) ΔH>0,若在0~15s内c(HI)由0.1mol·L-1降到0.07mol·L-1,则下列说法正确的是
H2(g)+I2(g) ΔH>0,若在0~15s内c(HI)由0.1mol·L-1降到0.07mol·L-1,则下列说法正确的是
A. 升高温度正反应速率加快,逆反应速率减慢
B. 减小反应体系的体积,化学反应速率加快
C. c(HI)由0.07mol·L-1降到0.05mol·L-1所需的反应时间小于10s
D. 0~15s内用I2表示的平均反应速率为v(I2)=0.002mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com