
【题目】化合物A的相对分子质量为136,其红外光谱和核磁共振氢谱如图,下列关于A的说法中正确的是( )

A. 若A可水解,与其同类的化合物![]() 包括
包括![]() 的同分异构体只有5种
的同分异构体只有5种
B. 符合题中A分子结构特征的有机物类型可能不只1类
C. A的可能结构中在一定条件下最多可与![]() 发生加成反应
发生加成反应
D. A一定属于酯类化合物,在一定条件下能发生水解反应
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠可作为脱氯剂,已知25.0 mL 0.100 mol·L-1 Na2S2O3溶液恰好把112 mL Cl2(标准状况下)完全转化为Cl-离子,则S2O32-将转化成
A.SO42-B.SO32-C.SD.S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的( )
A. 在稀溶液中,![]() ;
;![]() ,若将含
,若将含![]() 的硫酸与含1molNaOH的溶液混合,放出的热一定为
的硫酸与含1molNaOH的溶液混合,放出的热一定为![]()
B. 由![]() 石墨
石墨![]() 金刚石
金刚石![]() :
:![]() 可知,金刚石比石墨稳定
可知,金刚石比石墨稳定
C. 实验测得环己烷![]() 、环己烯
、环己烯![]() 和苯
和苯![]() 的标准燃烧分别为
的标准燃烧分别为![]() 、
、![]() 和
和![]() ,可以证明在苯分子中不存在独立的碳碳双键
,可以证明在苯分子中不存在独立的碳碳双键
D. 在101kPa时,![]() 完全燃烧生成液态水,放出
完全燃烧生成液态水,放出![]() 热量,则表示氢气燃烧热的热化学方程式为:
热量,则表示氢气燃烧热的热化学方程式为:![]() ;
;![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能力密度高、成本低、其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法不正确的是( )
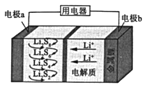
A. 石墨烯的作用主要是提高电极a的导电性
B. 电池工作时间越长,电极a极Li2S2的含量越高
C. 电池充电时,a极发生的反应为:3Li2S8+2Li++2e-=4Li2S6
D. 电池充电时,b极接外接电源的负极,每通过0.04mol电子b极增重0.28g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁红(Fe2O3)常用于油漆、油墨及橡胶工业。工业上以一定质量的硫铁矿烧渣(主要成分为Fe2O3、Fe3O4,另含少量难溶杂质)为主要原料制备铁红的一种工艺流程如下:
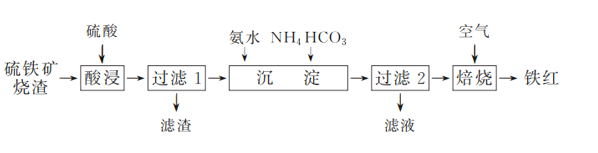
已知:某些过渡元素(如Cu、Fe、Ag等)的离子能与NH3、H2O、OH-、SCN-等形成可溶性配合物。
(1) 工业常将硫铁矿烧渣经过粉碎后再进行“酸浸”,其目的是________。
(2) “酸浸”时加入的硫酸不宜过量太多的原因是________。
(3) “过滤1”所得滤液中含有的阳离子有________。
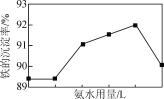
(4) “沉淀”过程中,控制NH4HCO3用量不变,铁的沉淀率随氨水用量变化如右图所示。当氨水用量超过一定体积时,铁的沉淀率下降。其可能的原因是________。
(5) “过滤2”所得滤渣的主要成分为FeOOH和FeCO3,所得滤液中的主要溶质是________(填化学式)。
(6) 写出FeCO3在空气中焙烧生成铁红的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,CO和CO2的混合气体共28L,质量为51g。其中CO2的质量为_____g,混合气体中CO的物质的量分数为____。混合气体的平均摩尔质量为_______。
(2)同温同压下,同质量的NH3和H2S气体体积比为______,原子个数之比为______,密度之比为________。
(3)在120℃时分别进行如下四个反应(除S外其它物质均为气体):
A.2H2S+O2=2H2O+2S↓ B.2H2S+3O2=2H2O+2SO2
C.C2H4+3O2=2H2O+2CO2 D.C4H8+6O2=4H2O+4CO2
若反应在压强恒定、容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和V前<V后的是___________;符合d前>d后和V前>V后的是___________(填写反应的代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟铝酸钠(Na3AlF6)是工业炼铝中重要的含氟添加剂。实验室以氟石(CaF2)、石英和纯碱为原料模拟工业制备氟铝酸钠的流程如下:
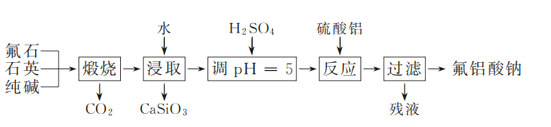
(1) “煅烧”时,固体药品混合后应置于________(填仪器名称)中加热。
(2) 通过控制分液漏斗的活塞可以调节添加液体的速率。调溶液pH接近5时,滴加稀硫酸的分液漏斗的活塞应如下图中的________(填序号)所示。

(3) 在酸性废水中加入Al2(SO4)3、Na2SO4混合溶液,可将废水中F-转换为氟铝酸钠沉淀。
① 该混合溶液中,Al2(SO4)3与Na2SO4的物质的量之比应≥________(填数值)。
②在不改变其他条件的情况下,加入NaOH调节溶液pH。实验测得溶液中残留氟浓度和氟去除率随溶液pH的变化关系如图所示。pH>5时,溶液中残留氟浓度增大的原因是________。
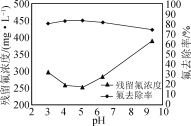
(4) 若用CaCl2作为沉淀剂除去F-,欲使F-浓度不超过0.95 mg·L-1,c(Ca2+)至少为________mol·L-1。[Ksp(CaF2)=2.7×10-11]
(5) 工业废铝屑(主要成分为铝,少量氧化铁、氧化铝)可用于制取硫酸铝晶体[Al2(SO4)3·18H2O]。
①请补充完整由废铝屑为原料制备硫酸铝晶体的实验方案:取一定量废铝屑,放入烧杯中,____________________________________________________________,得硫酸铝晶体。[已知:pH=5时,Al(OH)3沉淀完全;pH=8.5时,Al(OH)3沉淀开始溶解。须使用的试剂:3 mol·L-1 H2SO4溶液、2 mol·L-1 NaOH溶液、冰水]
②实验操作过程中,应保持强制通风,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冬季的降雪给交通带来了诸多不便,其中醋酸钾(CH3COOK)是融雪效果最好的融雪剂,下列关于醋酸钾的说法正确的是( )
A.1 molCH3COOK的质量为98g/mol
B.含有6.02×1023个碳原子的CH3COOK的物质的量是1mol
C.一个CH3COO-的质量约为![]() g
g
D.CH3COOK摩尔质量就是它的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
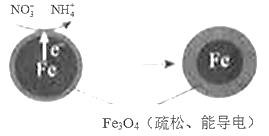
①作负极的物质是____。
②正极的电极反应式是____。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是____。
(4)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3-去除率和铁的最终物质形态不同的原因:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com