
【题目】下列说法或表示方法正确的( )
A. 在稀溶液中,![]() ;
;![]() ,若将含
,若将含![]() 的硫酸与含1molNaOH的溶液混合,放出的热一定为
的硫酸与含1molNaOH的溶液混合,放出的热一定为![]()
B. 由![]() 石墨
石墨![]() 金刚石
金刚石![]() :
:![]() 可知,金刚石比石墨稳定
可知,金刚石比石墨稳定
C. 实验测得环己烷![]() 、环己烯
、环己烯![]() 和苯
和苯![]() 的标准燃烧分别为
的标准燃烧分别为![]() 、
、![]() 和
和![]() ,可以证明在苯分子中不存在独立的碳碳双键
,可以证明在苯分子中不存在独立的碳碳双键
D. 在101kPa时,![]() 完全燃烧生成液态水,放出
完全燃烧生成液态水,放出![]() 热量,则表示氢气燃烧热的热化学方程式为:
热量,则表示氢气燃烧热的热化学方程式为:![]() ;
;![]()
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲用化学方法测量一个不规则容器的体积,把40 g NaOH放入烧杯中,加入一定量的蒸馏水。待NaOH完全溶解后,将溶液全部转移到容器中,用蒸馏水稀释至完全充满容器,从中取出溶液100 mL,该溶液恰好与20mL 1mol/L CuSO4溶液完全反应。
(1)写出CuSO4的摩尔质量______________。
(2)求配制的NaOH溶液的物质的量浓度______________。
(3)试计算该容器的体积______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠俗称纯碱,在日常生活和生活中有着广泛的应用.某化学兴趣小组想根据所学知识模拟制备碳酸钠,方法如下:先以NaCl、NH3、CO2和水等为原料以及下图所示装置制取NaHCO3(反应的化学方程式为NH3 + CO2 + H2O + NaCl = NaHCO3↓+ NH4Cl),然后再将NaHCO3制成Na2CO3。
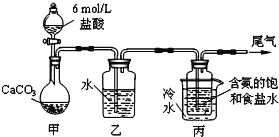
(1)装置乙的作用是_________。为防止污染空气,尾气中含有的_________需要进行吸收处理。
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有______、_______、____。NaHCO3转化为Na2CO3的化学方程式为_____________。
(3)若在(2)中反应时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3样品的组成进行了以下探究:取加热了t1 min的NaHCO3样品27.4g完全溶于水制成溶液,然后向此溶液中不断滴加1mol·L-1的稀盐酸直到不再产生气泡,共消耗400 mL稀盐酸。请回答下列问题:
①根据实验的需要,用密度为1.19g ·cm-3 质量分数为36.5%的浓盐酸配制1mol·L-1的稀盐酸时,主要用到的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管和____(填仪器名称);需要量取的浓盐酸体积为:_____mL。
② 该样品中NaHCO3和Na2CO3的物质的量之比是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为M的气态化合物V L(标准状况),溶于m g 水中(不与水反应),得到质量分数为w%的溶液,物质的量浓度为cmol/L,密度为ρ g·cm-3,则下列说法正确的是
A. 溶液密度ρ= ![]() B. 相对分子质量M=
B. 相对分子质量M=![]()
C. 物质的量浓度c=![]() D. 溶质的质量分数w%=
D. 溶质的质量分数w%=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关,下列关于生活中遇到的化学问题的描述不正确的是( )
A. 曾经风靡一时的DDT是卤代烃的一种
B. 维纶、油脂、天然橡胶、脲醛树脂都是由高分子化合物组成的物质
C. 甲醛水溶液可以防腐,但是不能用于食品类的保鲜剂
D. 可以将浸泡过高锰酸钾溶液的硅藻土于水果一起保存来达到水果保鲜的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按照课本实验要求,用50mL0.50mol/L的盐酸于50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热,下列说法中,正确的是( )
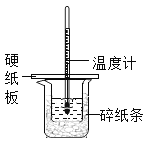
A. 烧杯间填满碎纸条的作用是固定小烧杯
B. 用如图装置可以完成中和热测定的实验
C. 为防止混合溶液时溅出产生误差,因此混合时速度要慢
D. 若将盐酸体积改为60mL,不考虑热量损失,理论上所求中和热相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ ![]() O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为________ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_____________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
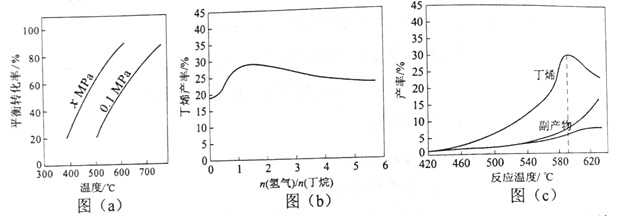
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A的相对分子质量为136,其红外光谱和核磁共振氢谱如图,下列关于A的说法中正确的是( )

A. 若A可水解,与其同类的化合物![]() 包括
包括![]() 的同分异构体只有5种
的同分异构体只有5种
B. 符合题中A分子结构特征的有机物类型可能不只1类
C. A的可能结构中在一定条件下最多可与![]() 发生加成反应
发生加成反应
D. A一定属于酯类化合物,在一定条件下能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应:![]()
(1)配平上述化学方程式并标出该反应中电子转移情况_____________________________
(2)该反应中的氧化剂是__________ ,被氧化的元素是_____________。
(3)1 mol Cl2参加反应,被氧化的NH3 的物质的量是_____________mol。
(4)若有68g NH3参加反应,电子转移的物质的量是_______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com