
【题目】研究碳氧化合物、氮氧化合物、硫氧化合物等大气污染物的处理对缓解环境污染、能源危机具有重要意义。工业上处理氮的氧化物途径有多种:
Ⅰ.碱吸法。
(1)利用纯碱溶液吸收NO、NO2,发生的反应共生成两种盐,请写出有关氧化还原方程式:______________________________________、NO+NO2+Na2CO3=2NaNO2+CO2
Ⅱ.催化氧化法:城市中NOx和CO污染主要来源于汽车尾气,可以利用化学方法将其转化为无毒无害的物质。
(2)已知:N2(g)+O2(g)![]() 2NO(g) ΔH=+180 kJ·mol-1
2NO(g) ΔH=+180 kJ·mol-1
2CO(g)+O2(g)![]() 2CO2(g) ΔH=-564 kJ·mol-1
2CO2(g) ΔH=-564 kJ·mol-1
请写出把汽车尾气转化为无毒无害的物质的热化学方程式:__________________________
(3)为研究汽车尾气转化为无毒无害的物质有关反应,在密闭容器中充入10molCO和8molNO,发生反应,如图为平衡时NO的体积分数与温度、压强的关系。

①该反应达到平衡后,为在提高反应速率同时提高NO的转化率,可采取的措施有__________(填字母序号)。
a.改用高效催化剂 b.缩小容器的体积 c.升高温度 d.增加CO的浓度
②压强为10 MPa、温度为T1下,若反应进行到20 min达到平衡状态,容器的体积为4 L,用CO2的浓度变化表示的平均反应速率v(CO2)=_______,该温度下平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;保留两位有效数字)。
③若在D点对反应容器降温的同时缩小体积至体系压强增大,重新达到的平衡状态可能是图中A~G点中的______点。
Ⅲ. 电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如图。

(4)N极的电极反应式为________。
(5)在25℃时,将a mol·L-1的氨水与0.1mol·L-1的硝酸等体积混合后溶液显中性,用含a的代数式表示NH4NO3的水解常数Kh=_____________。
【答案】NO2+Na2CO3=NaNO3+NaNO2+CO2 2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=-744 kJ·mol-1 bd 0.05mol/(L·min) 0.089MPa-1 (或4/45MPa-1) G NO-3e-+2H2O=NO3-+4H+ (10a-1)×10-7
2CO2(g)+N2(g) ΔH=-744 kJ·mol-1 bd 0.05mol/(L·min) 0.089MPa-1 (或4/45MPa-1) G NO-3e-+2H2O=NO3-+4H+ (10a-1)×10-7
【解析】
(1)NO2在碱性条件下容易发生歧化反应;
(2)根据盖斯定律,要注意题给信息汽车尾气为NOx和CO,这里指NO;
(3)2NO(g)+2CO(g)![]() 2CO2(g) +N2(g) ΔH=-744 kJ·mol-1,①该反应达到平衡后,为在提高反应速率同时提高NO的转化率,改变条件使平衡向正反应方向移动即可;
2CO2(g) +N2(g) ΔH=-744 kJ·mol-1,①该反应达到平衡后,为在提高反应速率同时提高NO的转化率,改变条件使平衡向正反应方向移动即可;
②利用“三段式”来解决化学平衡计算问题;
③此反应为放热反应,体积减少的反应,若在D点对反应容器降温的同时缩小体积至体系压强增大,平衡将向正反应方向移动;
(4)分析一下电解池,M电极的NO变成NH4+,N电极的NO变成NO3-,可知M电极为阴极,N电极为阳极,则N极的电极反应式为NO-3e-+2H2O=NO3-+4H+,此时溶液为NH4NO3,提供O元素的只能是H2O;
(5)NH4++H2O![]() NH3·H2O+H+,Kh=(c(NH3·H2O)·c(H+)/c(NH4+),a mol·L-1的氨水与0.1mol·L-1的硝酸等体积混合后溶液显中性,则c(H+)=
NH3·H2O+H+,Kh=(c(NH3·H2O)·c(H+)/c(NH4+),a mol·L-1的氨水与0.1mol·L-1的硝酸等体积混合后溶液显中性,则c(H+)=![]() ,c(NH3·H2O)和c(NH4+)可通过“三段式”来求出,再带入水解平衡常数公式。
,c(NH3·H2O)和c(NH4+)可通过“三段式”来求出,再带入水解平衡常数公式。
(1)NO2在碱性条件下容易发生歧化反应,生成NO2-,NO3-,氧化还原方程式:NO2+Na2CO3=NaNO3+NaNO2+CO2;
(2)根据盖斯定律,将反应1反向再与反应2加和即可得出答案,2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=-744 kJ·mol-1,注意要写反应条件,此为易错点;
2CO2(g)+N2(g) ΔH=-744 kJ·mol-1,注意要写反应条件,此为易错点;
(3)①该反应达到平衡后,为在提高反应速率同时提高NO的转化率,改变条件使平衡向正反应方向移动,a.改用高效催化剂,催化剂只能改变反应速率,不能改变反应平衡;b.缩小容器的体积,相当于增大压强,此反应是体积减少的反应,平衡向正反应方向移动,所以提高反应速率同时提高NO的转化率,正确;c.升高温度,反应速率提高,但该反应是放热反应,平衡向逆反应方向移动,错误;d.增加CO的浓度,浓度增大,反应速率加快,平衡向正反应方向移动,正确,故选b.d;
②压强为10 MPa、温度为T1下,若反应进行到20 min达到平衡状态,对应图像E点,利用“三段式”来计算:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g)
初始时物质的量/mol 8 10 0 0
变化的物质的量/mol x x x 0.5x
平衡时物质的量/mol 8-x 10-x x 0.5x
NO的体积分数为25%,根据阿伏加德罗定律及推论体积分数等于物质的量分数,(8-x)/( 8-x+10-x+x+0.5x)=25%,x=4,v(CO2)=![]() =0.05mol/(L·min),Kp=
=0.05mol/(L·min),Kp=![]() ,PCO2=总压×物质的量分数=P总
,PCO2=总压×物质的量分数=P总![]() Mpa,同理其它物质的分压也可以用类似的方法来求出,然后带入Kp=
Mpa,同理其它物质的分压也可以用类似的方法来求出,然后带入Kp=![]() =0.089MPa-1;
=0.089MPa-1;
③此反应是体积减少的反应,放热反应,在D点对反应容器降温的同时缩小体积至体系压强增大,平衡向正反应方向移动,NO的体积分数降低,对应图像的G点;
(4)电解池中M极的NO变成NH4+,N极的NO变成NO3-,故M极为阴极,N极为阳极,介质为NH4NO3溶液,N极的电极反应式为NO-3e-+2H2O=NO3-+4H+;
(5)NH4++H2O![]() NH3·H2O+H+,Kh=c(NH3·H2O)·c(H+)/c(NH4+),a mol·L-1的氨水与0.1mol·L-1的硝酸等体积混合后溶液显中性,则c(H+)=
NH3·H2O+H+,Kh=c(NH3·H2O)·c(H+)/c(NH4+),a mol·L-1的氨水与0.1mol·L-1的硝酸等体积混合后溶液显中性,则c(H+)=![]() ,c(NH3·H2O)和c(NH4+)可通过“三段式”来求出,氨水与硝酸等体积混合的离子方程式为:
,c(NH3·H2O)和c(NH4+)可通过“三段式”来求出,氨水与硝酸等体积混合的离子方程式为:
NH3·H2O+ H+ = NH4++ H2O
初始时物质的量浓度/mol/L a 0.1 0
变化的物质的量浓度/mol/L 0.1-![]() 0.1-
0.1-![]() 0.1-
0.1-![]()
平衡时物质的量浓度/mol/L a-0.1+![]()
![]() 0.1-
0.1-![]()
Kh=c(NH3·H2O)·c(H+)/c(NH4+)= (10a-1)×10-7


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质的叙述中正确的是
A. 苯与溴水混合,振荡静置后,上层液体无色,下层液体为橙红色
B. (CH3)3CCH2Br在NaOH的醇溶液中加热可发生消去反应
C. 乙烯、丙烯、聚乙烯等均能使溴水褪色,而甲烷、乙烷等则不能
D. 等质量的C2H4、聚乙烯( ![]() )分别完全燃烧,消耗O2的物质的量相同
)分别完全燃烧,消耗O2的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的说法正确的是( )
A.苯的分子式是C6H6,不能使酸性高锰酸钾溶液褪色,苯属于饱和烃
B.从苯的凯库勒式来看,分子中含有双键,所以苯是乙烯的同系物
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的化学键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物a和苯通过反应合成b的过程可表示为下图(无机小分子产物略去)。下列说法正确的是
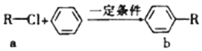
A. 该反应是加成反应
B. 若R为CH3时,b中所有原子可能共面
C. 若R为C4H9时,取代b苯环上的氢的一氯代物的可能的结构共有12种
D. 若R为C2H5时,1mol b最多可以与4molH2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为___________。已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,![]() =________。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
=________。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全_______________________。(提示:当某离子浓度小于10-5 mol·L-1时可以认为该离子沉淀完全)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应的应用比较广泛。阅读下面的材料,结合相关化学知识回答下列问题。
(1)黑火药主要是硝酸钾、硫磺、木炭三者粉末的混合物,在点燃条件下,其化学反应式主要为:KNO3+S+C →N2↑+CO2↑+K2S
①在黑火药燃烧的反应中,氧化剂为____,被氧化的物质为____。
②根据化学反应式分析,一个硫原子参与反应时___(得到或失去)___个电子。
(2)把Cl2通入浓氨水中,发生如下反应:3Cl2 +8NH3=6NH4Cl +N2。用双线桥表示反应的电子转移方向和数目:____。
(3)已知存在下列反应:①ClO3-+5Cl-+6H+ =3Cl2+3H2O②2FeCl2+Cl2=2FeCl3。则ClO3- 、Fe3+ 、Cl2三种微粒氧化能力由强到弱的顺序是____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算。
(1)含0.3 mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是___________。
(2)___________g H2O2所含原子数与0.2molH3PO4所含原子数相等。
(3)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是____________。
(4)如果规定,1mol粒子集合体所含的粒子数与0.024kg 12C中所含的碳原子数相同。那么将36.5gHCl溶于水中配成溶液500mL,则溶液的浓度为_____________mol/L。
(5)同温同压下,某容器充满氧气重116g,若充满二氧化碳重122g,现充满某气体重114g,则该气体的摩尔质量为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
A. 对该反应体系加热
B. 不用稀硫酸,改用98%的浓硫酸
C. 滴加少量CuSO4溶液
D. 不用铁片,改用铁粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com