
【题目】如图,C、D、E、F、X、Y都是惰性电极,A、B为电源。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.
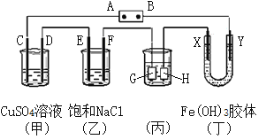
(1)若用CO、氧气燃料电池作电源,电解质为KOH溶液,则A为____极,A电极上的反应为__________________,B电极上的反应式为:__________________________________。
(2)若甲中装有100ml 1 molL-1的硫酸铜溶液,工作一段时间后,停止通电此时C、D两极上产生的气体体积相同.甲中D极产生的气体在标准状况下的体积为_____________L,欲使溶液恢复到起始状态,可向溶液中加入____。
A.CuO B.Cu2(OH)2CO3 C.Cu(OH)2 D.CuCO3
(3)通电后乙中反应的化学方程式:__________________________________。
(4)欲用(丙)装置给铜镀银,反应一段时间后(用CO、氧气燃料电池作电源)铜制品质量增加43.2克,理论上消耗氧气的质量_______克。
(5)工作一段时间后,丁中X极附件的颜色逐渐变浅,Y极附件的颜色逐渐变深,这说明__________________在电场作用下向Y极移动。
【答案】正 O2+4e-+2H2O=4OH- CO-2e-+4OH-=CO32-+2H2O 2.24 C 2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑ 3.2 氢氧化铁胶体粒子带正电荷
2NaOH+H2↑+Cl2↑ 3.2 氢氧化铁胶体粒子带正电荷
【解析】
本题考查的是电解池的工作原理,根据实验现象判断电解池的阴阳极和电极反应是关键。
(1)电解食盐水时F极附近显红色,说明F为阴极,则对应的B为负极,A为正极。若用CO、氧气燃料电池作电源,则氧气在正极反应生成氢氧根离子,电极反应为:O2+4e-+2H2O=4OH- ;一氧化碳在负极反应,电极反应为: CO-2e-+4OH-=CO32-+2H2O。(2) 若甲中装有100ml1 molL-1的硫酸铜溶液,说明首先电解硫酸铜生成铜和氧气和硫酸,然后电解水生成氢气和氧气,0.1mol硫酸铜完全电解生成0.05mol氧气,则假设电解水有xmol氧气生成,则同时生成2xmol氢气,有2x=x+0.05,解x=0.05mol,则D上产生0.1mol氢气,标况下体积为2.24L。 要想溶液恢复原来的成分和浓度需要加入0.1mol氧化铜和0.1mol水,或对应的物质,故选C。(3)通电后乙中为电解食盐水,生成氯气和氢气和氢氧化钠,方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。(4)欲用(丙)装置给铜镀银,反应一段时间后(用CO、氧气燃料电池作电源)铜制品质量增加43.2克,则说明析出43.2克银,即43.2/108=0.04mol银,则理论上消耗氧气0.01mol质量为3.2g。 (5)一段时间后X极附件的颜色逐渐变浅,Y极附件的颜色逐渐变深,说明氢氧化铁胶体粒子向阴极移动,则说明氢氧化铁胶体粒子带正电荷。
2NaOH+H2↑+Cl2↑。(4)欲用(丙)装置给铜镀银,反应一段时间后(用CO、氧气燃料电池作电源)铜制品质量增加43.2克,则说明析出43.2克银,即43.2/108=0.04mol银,则理论上消耗氧气0.01mol质量为3.2g。 (5)一段时间后X极附件的颜色逐渐变浅,Y极附件的颜色逐渐变深,说明氢氧化铁胶体粒子向阴极移动,则说明氢氧化铁胶体粒子带正电荷。


 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列四组物质,用横线上所给的试剂常温下就能鉴别出来的是( )
A.FeO、FeS、CuO、CuS、稀硫酸
B.苯、四氯化碳、无水乙醇、己烯 溴水
C.甲酸、乙酸、乙醛、乙醇 新制氢氧化铜悬浊液
D.苯酚钠溶液、甲苯、乙酸乙酯、乙酸 饱和碳酸钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃通过催化加氢后得到2-甲基丁烷,该烃不可能是( )
A. 3-甲基-1-丁炔B. 2-甲基-1-丁炔
C. 3-甲基-1-丁烯D. 2-甲基-1-丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现右图所示转化关系的是
X | Y | Z | 箭头上所标数字的反应条件 | ||
A. | NO | NO2 | HNO3 | ①常温遇氧气 |
|
B. | Cl2 | NaClO | HClO | ②通入CO2 | |
C. | Na2O2 | NaOH | NaCl | ③加入H2O2 | |
D. | Al2O3 | NaAlO2 | Al(OH)3 | ④加NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,分布在三个不同周期。X、Y、Z、W为这些元素形成的化合物,X为二元化合物且为强电解质,W的水溶液呈碱性,物质的转化关系如图所示。下列说法中正确的是
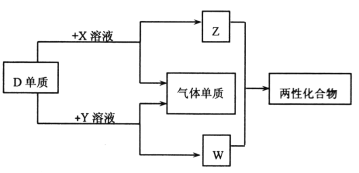
A. 对应的简单离子半径:C>D>B
B. D、E形成的化合物为含有极性共价键的共价化合物
C. 电解C、E形成的化合物水溶液,可生成C、E对应的单质
D. 由A、B、E形成的化合物都含有共价键,溶液都呈强酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是
A.向CaCl2 溶液中通入少量CO2气体:Ca2+ + CO2 + H2O=CaCO3↓ + 2H+
B.大理石与醋酸反应:CaCO3 + 2CH3COOH= Ca2+ + 2CH3COO-+ H2O + CO2↑
C.制备Fe(OH)3胶体:Fe3+ + 3H2O![]() Fe(OH)3(胶体)+ 3H+
Fe(OH)3(胶体)+ 3H+
D.少量碳酸氢钠溶液与足量石灰水反应:Ca2+ + OH-+ HCO3-=CaCO3↓ + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】血红蛋白(Hb)和肌红蛋白(Mb)分别存在于血液和肌肉中,都能与氧气结合,与氧气的结合度a(吸附O2的Hb或Mb的量占总Hb或Mb的量的比值)和氧气分压p(O2)密切相关。请回答下列问题:
(1)人体中的血红蛋白(Hb)能吸附O2、H+,相关反应的热化学方程式及平衡常数如下:
Ⅰ.Hb(aq)+H+(aq)![]() HbH+(aq) ΔH1 K1
HbH+(aq) ΔH1 K1
Ⅱ.HbH+(aq)+O2(g)![]() HbO2(aq)+H+(aq) ΔH2 K2
HbO2(aq)+H+(aq) ΔH2 K2
Ⅲ.Hb(aq)+O2(g)![]() HbO2(aq) ΔH3 K3
HbO2(aq) ΔH3 K3
ΔH3=_____(用ΔH1、ΔH2表示),K3=_____(用K1、K2表示)。
(2)Hb与氧气的结合能力受到c(H+)的影响,相关反应如下:HbO2(aq)+H+(aq)![]() HbH+(aq)+O2(g)。37 ℃,pH分别为7.2、7.4、7.6时氧气分压p(O2)与达到平衡时Hb与氧气的结合度
HbH+(aq)+O2(g)。37 ℃,pH分别为7.2、7.4、7.6时氧气分压p(O2)与达到平衡时Hb与氧气的结合度![]() 的关系如图1所示,pH=7.6时对应的曲线为_____(填“A”或“B”)。
的关系如图1所示,pH=7.6时对应的曲线为_____(填“A”或“B”)。
(3)Mb与氧气结合的反应如下:Mb(aq)+O2(g)![]() MbO2(aq) ΔH,37 ℃时,氧气分压p (O2)与达平衡时Mb与氧气的结合度a的关系如图2所示。
MbO2(aq) ΔH,37 ℃时,氧气分压p (O2)与达平衡时Mb与氧气的结合度a的关系如图2所示。

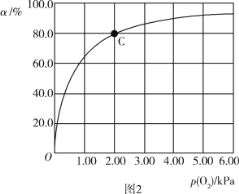
①已知Mb与氧气结合的反应的平衡常数的表达式K=![]() ,计算37 ℃时K=_____kPa-1。
,计算37 ℃时K=_____kPa-1。
②人正常呼吸时,体温约为37 ℃,氧气分压约为20.00 kPa,计算此时Mb与氧气的最大结合度为______(结果保留3位有效数字)。
③经测定,体温升高,Mb与氧气的结合度降低,则该反应的ΔH____(填“>”或“<”)0。
④已知37 ℃时,上述反应的正反应速率v(正)=k1·c(Mb)·p(O2),逆反应速率v(逆)=k2·c(MbO2),若k1=120 s-1·kPa-1,则k2=______。37 ℃时,图2中C点时,![]() =____。
=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂被誉为“高能金属”,是锂电池的电极材料,工业上用β-锂辉矿(主要成分为Li2O·Al2O3·4SiO2以及少量钙、镁杂质)和氟磷灰石(Ca5P3FO12)联合制取锂离子电池正极材料(LiFePO4),其工业生产流程如图:

已知:①Ksp[Al(OH)3]=2.7×10-34;
②LiFePO4难溶于水。
回答下列问题:
(1)氟磷灰石(Ca5P3FO12)中磷元素的化合价为___,沉淀X的主要成分是___(写化学式)。
(2)操作3的名称是___,操作1所需的玻璃仪器名称为___。
(3)蒸发浓缩Li2SO4溶液的目的是___。
(4)写出合成反应的离子方程式___。
(5)科学家设计一种锂电池的反应原理为LiFePO4![]() Li+FePO4,放电时正极反应式为___。
Li+FePO4,放电时正极反应式为___。
(6)工业上取300吨含氧化锂5%的β-锂辉矿石,经上述变化得到纯净的LiFePO4共110.6吨,则元素锂的利用率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 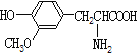 与
与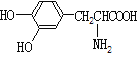 都是α-氨基酸且互为同系物
都是α-氨基酸且互为同系物
B. CH3CH=CHCH3分子中的四个碳原子在同一直线上
C. 按系统命名法,化合物按系统命名法,化合物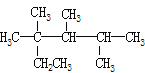 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷
D. ![]() 的一溴代物和
的一溴代物和![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com