
【题目】血红蛋白(Hb)和肌红蛋白(Mb)分别存在于血液和肌肉中,都能与氧气结合,与氧气的结合度a(吸附O2的Hb或Mb的量占总Hb或Mb的量的比值)和氧气分压p(O2)密切相关。请回答下列问题:
(1)人体中的血红蛋白(Hb)能吸附O2、H+,相关反应的热化学方程式及平衡常数如下:
Ⅰ.Hb(aq)+H+(aq)![]() HbH+(aq) ΔH1 K1
HbH+(aq) ΔH1 K1
Ⅱ.HbH+(aq)+O2(g)![]() HbO2(aq)+H+(aq) ΔH2 K2
HbO2(aq)+H+(aq) ΔH2 K2
Ⅲ.Hb(aq)+O2(g)![]() HbO2(aq) ΔH3 K3
HbO2(aq) ΔH3 K3
ΔH3=_____(用ΔH1、ΔH2表示),K3=_____(用K1、K2表示)。
(2)Hb与氧气的结合能力受到c(H+)的影响,相关反应如下:HbO2(aq)+H+(aq)![]() HbH+(aq)+O2(g)。37 ℃,pH分别为7.2、7.4、7.6时氧气分压p(O2)与达到平衡时Hb与氧气的结合度
HbH+(aq)+O2(g)。37 ℃,pH分别为7.2、7.4、7.6时氧气分压p(O2)与达到平衡时Hb与氧气的结合度![]() 的关系如图1所示,pH=7.6时对应的曲线为_____(填“A”或“B”)。
的关系如图1所示,pH=7.6时对应的曲线为_____(填“A”或“B”)。
(3)Mb与氧气结合的反应如下:Mb(aq)+O2(g)![]() MbO2(aq) ΔH,37 ℃时,氧气分压p (O2)与达平衡时Mb与氧气的结合度a的关系如图2所示。
MbO2(aq) ΔH,37 ℃时,氧气分压p (O2)与达平衡时Mb与氧气的结合度a的关系如图2所示。

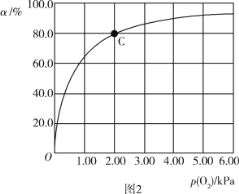
①已知Mb与氧气结合的反应的平衡常数的表达式K=![]() ,计算37 ℃时K=_____kPa-1。
,计算37 ℃时K=_____kPa-1。
②人正常呼吸时,体温约为37 ℃,氧气分压约为20.00 kPa,计算此时Mb与氧气的最大结合度为______(结果保留3位有效数字)。
③经测定,体温升高,Mb与氧气的结合度降低,则该反应的ΔH____(填“>”或“<”)0。
④已知37 ℃时,上述反应的正反应速率v(正)=k1·c(Mb)·p(O2),逆反应速率v(逆)=k2·c(MbO2),若k1=120 s-1·kPa-1,则k2=______。37 ℃时,图2中C点时,![]() =____。
=____。
【答案】△H1+△H2 K1·K2 A 2.00 97.6% < 60 s-1 1.00
【解析】
(1)根据盖斯定律,将热化学方程式叠加,可得待求反应的热化学方程式,利用化学平衡常数的含义计算反应III的化学平衡常数;
(2)当pH>7.4时,与pH=7.4时相比,氢离子浓度减小,HbO2(aq)+H+(aq)![]() HbH+(aq)+O2(g)的化学平衡逆向移动,增大了血红蛋白氧结合率;
HbH+(aq)+O2(g)的化学平衡逆向移动,增大了血红蛋白氧结合率;
(3)①假设反应开始时Mb的浓度为1,根据物质的转化率,结合物质反应转化关系可计算该反应的化学平衡常数;
②根据K=![]() 可得a,带入p(O2)=20.0kPa可得a;
可得a,带入p(O2)=20.0kPa可得a;
③根据温度对化学平衡移动的影响分析反应热;
④根据化学反应达到平衡时v(正)=v(逆)及37℃时的平衡常数计算k2,根据37 ℃时反应平衡常数及图2中C点时结合度计算![]() 的值。
的值。
(1)已知:①Hb(aq)+H+(aq)![]() HbH+(aq) ΔH1 K1
HbH+(aq) ΔH1 K1
②HbH+(aq)+O2(g)![]() HbO2(aq)+H+(aq) ΔH2 K2
HbO2(aq)+H+(aq) ΔH2 K2
由于反应热与反应途径无关,所以①+②,整理可得:Hb(aq)+O2(g)![]() HbO2(aq) ΔH3=△H1+△H2,
HbO2(aq) ΔH3=△H1+△H2,
K1=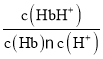 ,K2=
,K2=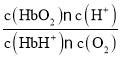 ,K3=
,K3=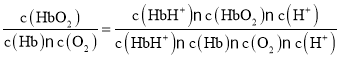 =
=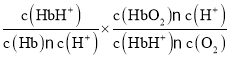 = K1·K2;
= K1·K2;
(2)当pH>7.4时,与pH=7.4时相比,氢离子浓度减小,HbO2(aq)+H+(aq)![]() HbH+(aq)+O2(g)的化学平衡逆向移动,增大了血红蛋白氧结合率,所以根据图示可知曲线A符合要求;
HbH+(aq)+O2(g)的化学平衡逆向移动,增大了血红蛋白氧结合率,所以根据图示可知曲线A符合要求;
(3)①对于反应Mb(aq)+O2(g)![]() MbO2(aq),假设反应开始时Mb的浓度为1,转化率为a,则平衡时c(Mb)=(1-a),c(MbO2)=a,K=
MbO2(aq),假设反应开始时Mb的浓度为1,转化率为a,则平衡时c(Mb)=(1-a),c(MbO2)=a,K=![]() ,根据图示可知p(O2)=2.0kPa,a=80%,带入可得K=
,根据图示可知p(O2)=2.0kPa,a=80%,带入可得K=![]() =2;
=2;
②人正常呼吸时,体温约为37 ℃,此时的化学平衡常数K=2.0化学平衡常数K=![]() , p(O/span>2)=20.0 kPa,则人正常呼吸时2=
, p(O/span>2)=20.0 kPa,则人正常呼吸时2=![]() ,解得a=97.6%;
,解得a=97.6%;
③经测定,体温升高,Mb与氧气的结合度降低,结合平衡移动原理:升高温度,化学平衡向吸热反应方向移动,说明升高温度化学平衡逆向移动,逆反应为吸热反应,则该反应的正反应为放热反应,所以ΔH<0;
④当反应达到平衡时,v(正)= v(逆),由于v(正)=k1·c(Mb)·p(O2),逆反应速率v(逆)=k2·c(MbO2),所以k1·c(Mb)·p(O2)= k2·c(MbO2),则![]() =K=2.0kPa,若k1=120 s-1·kPa-1,则k2=
=K=2.0kPa,若k1=120 s-1·kPa-1,则k2=![]() s-1=60 s-1;
s-1=60 s-1;
在图2中的C点,a=80%,处于平衡线上,则v(正)= v(逆),故![]() =1.00。
=1.00。


 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如图: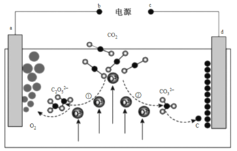
下列说法不正确的是( )
A.b为电源的负极
B.①②中,捕获CO2时碳元素的化合价发生了变化
C.a极的电极反应式为2C2O52﹣-4e﹣=4CO2+O2
D.上述装置存在反应:CO2![]() C+O2
C+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的数目是
①12.0g熔融的NaHSO4中含有的阳离子数为0.2NA
②1mol Na2O 和Na2O2混合物中含有的阴、阴离子总数是3NA
③常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
④7.8g![]() 中含有的碳碳双键数目为0.3NA
中含有的碳碳双键数目为0.3NA
⑤用1L1.0 mol/LFeCl3溶液制备氢氧化铁胶体,所得氢氧化铁胶粒的数目为NA
⑥1mol SO2与足量O2在一定条件下充分反应生成SO3,共转移2NA个电子
⑦在反应KIO3+6HI=KI+3I2 +3H2O 中,每生成3molI2转移的电子数为5NA
⑧常温常压下,17 g甲基(-14CH3)中所含的中子数为9NA
A. 3 B. 4 C. 5 D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,C、D、E、F、X、Y都是惰性电极,A、B为电源。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.
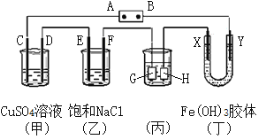
(1)若用CO、氧气燃料电池作电源,电解质为KOH溶液,则A为____极,A电极上的反应为__________________,B电极上的反应式为:__________________________________。
(2)若甲中装有100ml 1 molL-1的硫酸铜溶液,工作一段时间后,停止通电此时C、D两极上产生的气体体积相同.甲中D极产生的气体在标准状况下的体积为_____________L,欲使溶液恢复到起始状态,可向溶液中加入____。
A.CuO B.Cu2(OH)2CO3 C.Cu(OH)2 D.CuCO3
(3)通电后乙中反应的化学方程式:__________________________________。
(4)欲用(丙)装置给铜镀银,反应一段时间后(用CO、氧气燃料电池作电源)铜制品质量增加43.2克,理论上消耗氧气的质量_______克。
(5)工作一段时间后,丁中X极附件的颜色逐渐变浅,Y极附件的颜色逐渐变深,这说明__________________在电场作用下向Y极移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(1)中加入CaO,在(2)中不加其他任何物质,在(3)中加入NH4Cl晶体,发现(1)中红棕色变深,(3)中红棕色变浅。[已知反应2NO2(红棕色) N2O4(无色)]

下列叙述正确的是( )
A.2NO2N2O4是放热反应
B.NH4Cl溶于水时放出热量
C.烧瓶(1)中平衡混合气体的平均相对分子质量增大
D.烧瓶(3)中气体的压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列说法错误的是![]()
![]()
A.泡沫灭火器可用于一般的起火,也适用于电器起火
B.绿色化学要求从源头上消除或减少生产活动对环境的污染
C.锅炉水垢中含有的![]() ,可先用
,可先用![]() 溶液处理,后用酸除去
溶液处理,后用酸除去
D.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中的Ⅰ是某抗肿瘤药物的中间体,B的核磁共振氢谱有3组峰,C的分子式为C7H8O,D分子中有两个相同且处于相邻位置的含氧官能团,E的相对分子质量比D大34.5。
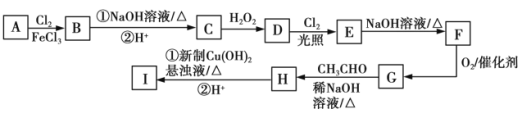
已知:RCHO+R1CH2CHO![]() RCH=C(R1)CHO+H2O。
RCH=C(R1)CHO+H2O。
请回答下列问题:
(1)C的名称是______,B的结构简式为_________,D转化为E的反应类型是____________。
(2)I中官能团的名称为______,I的分子式为________。
(3)写出E转化为F的化学方程式____________。
(4)X是G酸化后的产物,X有多种芳香族同分异构体,符合下列条件且能发生银镜反应的同分异构体有____种(不包括X),写出核磁共振氢谱有4组峰的物质的结构简式____________。
①遇FeCl3溶液发生显色反应 ②苯环上有两种类型的取代基
(5)参照上述流程,以乙醇为原料(其他无机试剂自选)可制取2﹣丁烯酸,写出相应的合成路线__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是生命的基础,近几年科学家们纷纷掀起了研究碳的热潮。回答下列问题:
(1)2019年人们“谈霾色变”,汽车尾气是雾霾的罪魁之一。汽车尾气净化的原理为:2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH<0。
某温度下,恒容的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
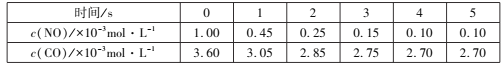
①2s内用N2表示的化学反应速率为___,该温度下,反应的化学平衡常数为___。
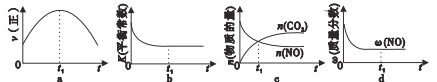
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是___(填代号)。
(2)用CH4催化还原NOx也可以减少氮的污染。
已知:CH4(g)+2NO2(g)= CO2(g)+ N2(g)+2H2O(g) ΔH=867kJ/mol
2NO2(g)=N2O4(g) ΔH=-56.9kJ/mol
H2O(g)=H2O(l) ΔH=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(1)的热化学方程式:___。
(3)常温常压下,测得向水中通入足量的CO2后,水溶液的pH=5.6。
①若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3-+H+的平衡常数K大约为___。(已知:溶液中c(H2CO3)=1.5×10-5 molL1,10-5.6=2.5×10-6)
HCO3-+H+的平衡常数K大约为___。(已知:溶液中c(H2CO3)=1.5×10-5 molL1,10-5.6=2.5×10-6)
②常温下,测得NaHCO3溶液呈碱性,则溶液中c(H2CO3)___c(CO32-)(填“>”“”或“<”),原因是___ (用离子方程式和必要的文字说明)。
③锅炉中的CaSO4沉淀可用可溶性碳酸盐浸取,然后加酸除去,浸取过程中会发生反应:CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq)。
CaCO3(s)+SO42-(aq)。
已知298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为___(计算结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用废铁屑制备磁性胶体粒子,制取过程如下:

下列说法不正确的是
A. 用Na2CO3溶液浸泡是为了除去废铁屑表面的油污
B. 通入N2是防止空气中的O2氧化二价铁元素
C. 加适量的H2O2是为了将部分Fe2+氧化为Fe3+,涉及反应:H2O2+2Fe2++2H+=2Fe3++2 H2O
D. 溶液A中Fe2+和Fe3+的浓度比为2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com