
ЁОЬтФПЁПЬМЪЧЩњУќЕФЛљДЁЃЌНќМИФъПЦбЇМвУЧЗзЗзЯЦЦ№СЫбаОПЬМЕФШШГБЁЃЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉ2019ФъШЫУЧЁАЬИіВЩЋБфЁБЃЌЦћГЕЮВЦјЪЧЮэіВЕФзяП§жЎвЛЁЃЦћГЕЮВЦјОЛЛЏЕФдРэЮЊЃК2NO(g)+2CO(g)=2CO2(g)+N2(g) ІЄHЃМ0ЁЃ
ФГЮТЖШЯТЃЌКуШнЕФУмБеШнЦїжаЭЈШыNOКЭCOЃЌВтЕУВЛЭЌЪБМфЕФNOКЭCOЕФХЈЖШШчЯТБэЃК
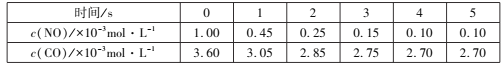
Ђй2sФкгУN2БэЪОЕФЛЏбЇЗДгІЫйТЪЮЊ___ЃЌИУЮТЖШЯТЃЌЗДгІЕФЛЏбЇЦНКтГЃЪ§ЮЊ___ЁЃ
ЂкШєИУЗДгІдкОјШШЁЂКуШнЕФУмБеЬхЯЕжаНјааЃЌЯТСаЪОвтЭМе§ШЗЧвФмЫЕУїЗДгІдкНјааЕНt1ЪБПЬДяЕНЦНКтзДЬЌЕФЪЧ___(ЬюДњКХ)ЁЃ
ЃЈ2ЃЉгУCH4ДпЛЏЛЙдNOxвВПЩвдМѕЩйЕЊЕФЮлШОЁЃ
вбжЊЃКCH4(g)+2NO2(g)= CO2(g)+ N2(g)+2H2O(g) ІЄH=867kJ/mol
2NO2(g)=N2O4(g) ІЄH=-56.9kJ/mol
H2O(g)=H2O(l) ІЄH=-44.0kJ/mol
аДГіCH4ДпЛЏЛЙдN2O4(g)ЩњГЩN2КЭH2OЃЈ1ЃЉЕФШШЛЏбЇЗНГЬЪНЃК___ЁЃ
ЃЈ3ЃЉГЃЮТГЃбЙЯТЃЌВтЕУЯђЫЎжаЭЈШызуСПЕФCO2КѓЃЌЫЎШмвКЕФpH=5.6ЁЃ
ЂйШєКіТдЫЎЕФЕчРыМАH2CO3ЕФЕкЖўМЖЕчРыЃЌдђH2CO3![]() HCO3-+H+ЕФЦНКтГЃЪ§KДѓдМЮЊ___ЁЃ(вбжЊЃКШмвКжаc(H2CO3)=1.5ЁС10-5 molL1ЃЌ10-5.6=2.5ЁС10-6)
HCO3-+H+ЕФЦНКтГЃЪ§KДѓдМЮЊ___ЁЃ(вбжЊЃКШмвКжаc(H2CO3)=1.5ЁС10-5 molL1ЃЌ10-5.6=2.5ЁС10-6)
ЂкГЃЮТЯТЃЌВтЕУNaHCO3ШмвКГЪМюадЃЌдђШмвКжаc(H2CO3)___c(CO32-)(ЬюЁА>ЁБЁАЁБЛђЁА<ЁБ)ЃЌдвђЪЧ___ (гУРызгЗНГЬЪНКЭБивЊЕФЮФзжЫЕУї)ЁЃ
ЂлЙјТЏжаЕФCaSO4ГСЕэПЩгУПЩШмадЬМЫсбЮНўШЁЃЌШЛКѓМгЫсГ§ШЅЃЌНўШЁЙ§ГЬжаЛсЗЂЩњЗДгІЃКCaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq)ЁЃ
CaCO3(s)+SO42-(aq)ЁЃ
вбжЊ298KЪБЃЌKsp(CaCO3)=2.80ЁС10-9ЃЌKsp(CaSO4)=4.90ЁС10-5ЃЌдђДЫЮТЖШЯТИУЗДгІЕФЦНКтГЃЪ§KЮЊ___(МЦЫуНсЙћБЃСєШ§ЮЛгааЇЪ§зж)ЁЃ
ЁОД№АИЁП1.875ЁС104 molL1s1 5000 bd CH4(g) + N2O4 (g) = CO2(g)+N2(g)+2H2O(l) ІЄH= 898.1 kJЁЄmol1 4.2ЁС107 molL1 > ЬМЫсЧтФЦШмвКжаДцдкЫЎНтЦНКтHCO3Ѓ+H2O![]() H2CO3 + OHЃКЭЕчРыЦНКтHCO3Ѓ
H2CO3 + OHЃКЭЕчРыЦНКтHCO3Ѓ![]() CO32+H+ЃЌЫЎНтГЬЖШДѓгкЕчРыГЬЖШЃЌШмвКЯдМюад 1.75ЁС104
CO32+H+ЃЌЫЎНтГЬЖШДѓгкЕчРыГЬЖШЃЌШмвКЯдМюад 1.75ЁС104
ЁОНтЮіЁП
ЂХЂйЯШМЦЫуЧА2sФкЕФІЄc(NO)ЃЌдйМЦЫуІЄc(N2)КЭЦНОљЗДгІЫйТЪЃЌЯШМЦЫуЦНКтЪБУПИіЮяжЪЕФХЈЖШЃЌдйМЦЫуЦНКтГЃЪ§ЁЃ
Ђкa. ЗДгІДяЕНЦНКтЪБЃЌИїЮяжЪЕФЫйТЪВЛдйИФБфЃЛb. ОјШШШнЦїжаЃЌЗДгІЗХШШЃЌЮТЖШЩ§ИпЃЌЦНКтГЃЪ§МѕаЁЃЌЕБЦНКтГЃЪ§МѕаЁЕНВЛИФБфЪБЃЌдђДяЕНЦНКтЃЛc. етСНепЕФЮяжЪЕФСПЯрЕШВЛвЛЖЈФмЫЕУїДяЕНЦНКтЃЌжЛгаетСНепЕФЮяжЪЕФСПВЛдйИФБфЃЌдђДяЕНЦНКтЃЛd. жЪСПЗжЪ§ВЛдйИФБфЃЌдђДяЕНЦНКтЁЃ
ЂЦЕквЛИіЗНГЬЪНМѕШЅЕкЖўИіЗНГЬЪНдйМгЕкШ§ИіЗНГЬЪНЕФ2БЖЁЃ
ЂЧИљОнЕчРыЦНКтМЦЫуЦНКтГЃЪ§ЃЛЂкГЃЮТЯТЃЌВтЕУNaHCO3ШмвКГЪМюадЃЌжївЊдвђЪЧЬМЫсЧтФЦШмвКжаДцдкЫЎНтЦНКтHCO3Ѓ+H2O![]() H2CO3 + OHЃКЭЕчРыЦНКтHCO3Ѓ
H2CO3 + OHЃКЭЕчРыЦНКтHCO3Ѓ![]() CO32+H+ЃЌЫЎНтГЬЖШДѓгкЕчРыГЬЖШЃЌШмвКЯдМюадЃЛЂлНўШЁЙ§ГЬжаЛсЗЂЩњЗДгІЃКCaSO4(s)+CO32 (aq)
CO32+H+ЃЌЫЎНтГЬЖШДѓгкЕчРыГЬЖШЃЌШмвКЯдМюадЃЛЂлНўШЁЙ§ГЬжаЛсЗЂЩњЗДгІЃКCaSO4(s)+CO32 (aq)![]() CaCO3(s)+SO42 (aq)ЃЌИљОнЦНКтГЃЪ§КЭШмЖШЛ§ГЃЪ§НјааМЦЫуЁЃ
CaCO3(s)+SO42 (aq)ЃЌИљОнЦНКтГЃЪ§КЭШмЖШЛ§ГЃЪ§НјааМЦЫуЁЃ
ЂХЂйЧА2sФкЕФІЄc(NO) =(1.00Ѓ0.25)ЁС103 molЁЄL1 =7.50ЁС104 molЁЄL1ЃЌдђІЄc(N2) = ![]() ЁС7.50ЁС104 molЁЄL1=3.75ЁС104 molЁЄL1ЃЌЦНОљЗДгІЫйТЪ
ЁС7.50ЁС104 molЁЄL1=3.75ЁС104 molЁЄL1ЃЌЦНОљЗДгІЫйТЪ![]() ЃЛЗДгІДяЕНЦНКтЪБc(CO) =1ЁС104 molЁЄL1ЃЌc(NO)= 2.7ЁС103 molЁЄL1ЃЌc(N2) =ІЄc(N2) =
ЃЛЗДгІДяЕНЦНКтЪБc(CO) =1ЁС104 molЁЄL1ЃЌc(NO)= 2.7ЁС103 molЁЄL1ЃЌc(N2) =ІЄc(N2) = ![]() ЁС9ЁС104 molЁЄL1=4.5ЁС104 molЁЄL1ЃЌдђc(CO2) =ІЄc(CO2) =ІЄc(CO)= 9ЁС104 molЁЄL1ЃЌИУЮТЖШЯТЃЌЗДгІЕФЛЏбЇЦНКтГЃЪ§ЮЊ
ЁС9ЁС104 molЁЄL1=4.5ЁС104 molЁЄL1ЃЌдђc(CO2) =ІЄc(CO2) =ІЄc(CO)= 9ЁС104 molЁЄL1ЃЌИУЮТЖШЯТЃЌЗДгІЕФЛЏбЇЦНКтГЃЪ§ЮЊ![]() ЃЛЙЪД№АИЮЊЃК1.875ЁС104 molL1s1ЃЛ5000ЁЃ
ЃЛЙЪД№АИЮЊЃК1.875ЁС104 molL1s1ЃЛ5000ЁЃ
Ђкa. ЗДгІДяЕНЦНКтЪБЃЌИїЮяжЪЕФЫйТЪВЛдйИФБфЃЌЙЪaВЛЗћКЯЬтвтЃЛb. ОјШШШнЦїжаЃЌЗДгІЗХШШЃЌЮТЖШЩ§ИпЃЌЦНКтГЃЪ§МѕаЁЃЌЕБЦНКтГЃЪ§МѕаЁЕНВЛИФБфЪБЃЌдђДяЕНЦНКтЃЌЙЪbЗћКЯЬтвтЃЛc. етСНепЕФЮяжЪЕФСПЯрЕШВЛвЛЖЈФмЫЕУїДяЕНЦНКтЃЌжЛгаетСНепЕФЮяжЪЕФСПВЛдйИФБфЃЌдђДяЕНЦНКтЃЌЙЪcВЛЗћКЯЬтвтЃЛd. жЪСПЗжЪ§ВЛдйИФБфЃЌдђДяЕНЦНКтЃЌЙЪdЗћКЯЬтвтЃЛзлЩЯЫљЪіЃЌД№АИЮЊbdЁЃ
ЂЦЕквЛИіЗНГЬЪНМѕШЅЕкЖўИіЗНГЬЪНдйМгЕкШ§ИіЗНГЬЪНЕФ2БЖЃЌМДЕУCH4ДпЛЏЛЙдN2O4(g)ЩњГЩN2КЭH2O(l)ЕФШШЛЏбЇЗНГЬЪНЃКCH4(g) + N2O4 (g) = CO2(g)+N2(g)+2H2O(l) ІЄH= 867 kJЁЄmol1(56.9 kJЁЄmol1) +2ЁС(44 kJЁЄmol1) = 898.1 kJЁЄmol1ЃЛЙЪД№АИЮЊЃКCH4(g) + N2O4 (g) = CO2(g)+N2(g)+2H2O(l) ІЄH= 898.1 kJЁЄmol1ЁЃ
ЂЧЂйКіТдЫЎЕФЕчРыМАH2CO3ЕФЕкЖўМЖЕчРыЃЌдђH2CO3![]() HCO3Ѓ+H+ЕФЦНКтГЃЪ§KДѓдМЮЊ
HCO3Ѓ+H+ЕФЦНКтГЃЪ§KДѓдМЮЊ ЃЛЙЪД№АИЮЊЃК4.2ЁС107 molL1ЁЃ
ЃЛЙЪД№АИЮЊЃК4.2ЁС107 molL1ЁЃ
ЂкГЃЮТЯТЃЌВтЕУNaHCO3ШмвКГЪМюадЃЌдвђЪЧЬМЫсЧтФЦШмвКжаДцдкЫЎНтЦНКтHCO3Ѓ+H2O![]() H2CO3 + H+КЭЕчРыЦНКтHCO3Ѓ
H2CO3 + H+КЭЕчРыЦНКтHCO3Ѓ![]() CO32+H+ЃЌЫЎНтГЬЖШДѓгкЕчРыГЬЖШЃЌШмвКЯдМюадЃЌвђДЫШмвКжаc(H2CO3) >c(CO32)ЃЛЙЪД№АИЮЊЃК>ЃЛЬМЫсЧтФЦШмвКжаДцдкЫЎНтЦНКтHCO3Ѓ+H2O
CO32+H+ЃЌЫЎНтГЬЖШДѓгкЕчРыГЬЖШЃЌШмвКЯдМюадЃЌвђДЫШмвКжаc(H2CO3) >c(CO32)ЃЛЙЪД№АИЮЊЃК>ЃЛЬМЫсЧтФЦШмвКжаДцдкЫЎНтЦНКтHCO3Ѓ+H2O![]() H2CO3 + OHЃКЭЕчРыЦНКтHCO3Ѓ
H2CO3 + OHЃКЭЕчРыЦНКтHCO3Ѓ![]() CO32+H+ЃЌЫЎНтГЬЖШДѓгкЕчРыГЬЖШЃЌШмвКЯдМюадЁЃ
CO32+H+ЃЌЫЎНтГЬЖШДѓгкЕчРыГЬЖШЃЌШмвКЯдМюадЁЃ
ЂлНўШЁЙ§ГЬжаЛсЗЂЩњЗДгІЃКCaSO4(s)+CO32 (aq)![]() CaCO3(s)+SO42 (aq)ЃЌ
CaCO3(s)+SO42 (aq)ЃЌ
 ЃЛЙЪД№АИЮЊЃК1.75ЁС104ЁЃ
ЃЛЙЪД№АИЮЊЃК1.75ЁС104ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЬўЭЈЙ§ДпЛЏМгЧтКѓЕУЕН2ЃМзЛљЖЁЭщЃЌИУЬўВЛПЩФмЪЧ( )
A. 3ЃМзЛљЃ1ЃЖЁШВB. 2ЃМзЛљЃ1ЃЖЁШВ
C. 3ЃМзЛљЃ1ЃЖЁЯЉD. 2ЃМзЛљЃ1ЃЖЁЯЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПбЊКьЕААз(Hb)КЭМЁКьЕААз(Mb)ЗжБ№ДцдкгкбЊвККЭМЁШтжаЃЌЖМФмгыбѕЦјНсКЯЃЌгыбѕЦјЕФНсКЯЖШa(ЮќИНO2ЕФHbЛђMbЕФСПеМзмHbЛђMbЕФСПЕФБШжЕ)КЭбѕЦјЗжбЙp(O2)УмЧаЯрЙиЁЃЧыЛиД№ЯТСаЮЪЬтЃК
(1)ШЫЬхжаЕФбЊКьЕААз(Hb)ФмЮќИНO2ЁЂH+ЃЌЯрЙиЗДгІЕФШШЛЏбЇЗНГЬЪНМАЦНКтГЃЪ§ШчЯТЃК
ЂёЃЎHb(aq)+HЃЋ(aq)![]() HbHЃЋ(aq) ЁЁІЄH1ЁЁK1
HbHЃЋ(aq) ЁЁІЄH1ЁЁK1
ЂђЃЎHbHЃЋ(aq)ЃЋO2(g)![]() HbO2(aq)+HЃЋ(aq)ЁЁІЄH2ЁЁK2
HbO2(aq)+HЃЋ(aq)ЁЁІЄH2ЁЁK2
ЂѓЃЎHb(aq)ЃЋO2(g)![]() HbO2(aq)ЁЁІЄH3ЁЁK3
HbO2(aq)ЁЁІЄH3ЁЁK3
ІЄH3=_____ЃЈгУІЄH1ЁЂІЄH2БэЪОЃЉЃЌK3=_____ЃЈгУK1ЁЂK2БэЪОЃЉЁЃ
(2)HbгыбѕЦјЕФНсКЯФмСІЪмЕНc(HЃЋ)ЕФгАЯьЃЌЯрЙиЗДгІШчЯТЃКHbO2(aq)+HЃЋ(aq)![]() HbHЃЋ(aq)+O2(g)ЁЃ37 ЁцЃЌpHЗжБ№ЮЊ7.2ЁЂ7.4ЁЂ7.6ЪБбѕЦјЗжбЙp(O2)гыДяЕНЦНКтЪБHbгыбѕЦјЕФНсКЯЖШ
HbHЃЋ(aq)+O2(g)ЁЃ37 ЁцЃЌpHЗжБ№ЮЊ7.2ЁЂ7.4ЁЂ7.6ЪБбѕЦјЗжбЙp(O2)гыДяЕНЦНКтЪБHbгыбѕЦјЕФНсКЯЖШ![]() ЕФЙиЯЕШчЭМ1ЫљЪОЃЌpH=7.6ЪБЖдгІЕФЧњЯпЮЊ_____ЃЈЬюЁАAЁБЛђЁАBЁБЃЉЁЃ
ЕФЙиЯЕШчЭМ1ЫљЪОЃЌpH=7.6ЪБЖдгІЕФЧњЯпЮЊ_____ЃЈЬюЁАAЁБЛђЁАBЁБЃЉЁЃ
(3)MbгыбѕЦјНсКЯЕФЗДгІШчЯТЃКMb(aq)+O2(g)![]() MbO2(aq)ЁЁІЄHЃЌ37 ЁцЪБЃЌбѕЦјЗжбЙp (O2)гыДяЦНКтЪБMbгыбѕЦјЕФНсКЯЖШaЕФЙиЯЕШчЭМ2ЫљЪОЁЃ
MbO2(aq)ЁЁІЄHЃЌ37 ЁцЪБЃЌбѕЦјЗжбЙp (O2)гыДяЦНКтЪБMbгыбѕЦјЕФНсКЯЖШaЕФЙиЯЕШчЭМ2ЫљЪОЁЃ
 ЁЁ
ЁЁ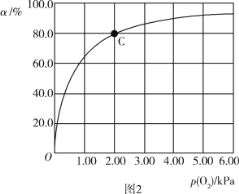
ЂйвбжЊMbгыбѕЦјНсКЯЕФЗДгІЕФЦНКтГЃЪ§ЕФБэДяЪНK=![]() ЃЌМЦЫу37 ЁцЪБK=_____kPa-1ЁЃ
ЃЌМЦЫу37 ЁцЪБK=_____kPa-1ЁЃ
ЂкШЫе§ГЃКєЮќЪБЃЌЬхЮТдМЮЊ37 ЁцЃЌбѕЦјЗжбЙдМЮЊ20.00 kPaЃЌМЦЫуДЫЪБMbгыбѕЦјЕФзюДѓНсКЯЖШЮЊ______ЃЈНсЙћБЃСє3ЮЛгааЇЪ§зжЃЉЁЃ
ЂлОВтЖЈЃЌЬхЮТЩ§ИпЃЌMbгыбѕЦјЕФНсКЯЖШНЕЕЭЃЌдђИУЗДгІЕФІЄH____ЃЈЬюЁА>ЁБЛђЁА<ЁБЃЉ0ЁЃ
ЂмвбжЊ37 ЁцЪБЃЌЩЯЪіЗДгІЕФе§ЗДгІЫйТЪv(е§)=k1ЁЄc(Mb)ЁЄp(O2)ЃЌФцЗДгІЫйТЪv(Фц)=k2ЁЄc(MbO2)ЃЌШєk1=120 s-1ЁЄkPa-1ЃЌдђk2=______ЁЃ37 ЁцЪБЃЌЭМ2жаCЕуЪБЃЌ![]() =____ЁЃ
=____ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП2019ФъХЕБДЖћЛЏбЇНБЪкгшдкПЊЗЂяЎРызгЕчГиЗНУцзіГізПдНЙБЯзЕФШ§ЮЛЛЏбЇМвЁЃяЎБЛгўЮЊЁАИпФмН№ЪєЁБЃЌЪЧяЎЕчГиЕФЕчМЋВФСЯЃЌЙЄвЕЩЯгУІТ-яЎЛдПѓ(жївЊГЩЗжЮЊLi2OЁЄAl2O3ЁЄ4SiO2вдМАЩйСПИЦЁЂУОдгжЪ)КЭЗњСзЛвЪЏ(Ca5P3FO12)СЊКЯжЦШЁяЎРызгЕчГие§МЋВФСЯ(LiFePO4)ЃЌЦфЙЄвЕЩњВњСїГЬШчЭМЃК

вбжЊЃКЂйKsp[Al(OH)3]=2.7ЁС10-34ЃЛ
ЂкLiFePO4ФбШмгкЫЎЁЃ
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЗњСзЛвЪЏ(Ca5P3FO12)жаСздЊЫиЕФЛЏКЯМлЮЊ___ЃЌГСЕэXЕФжївЊГЩЗжЪЧ___(аДЛЏбЇЪН)ЁЃ
ЃЈ2ЃЉВйзї3ЕФУћГЦЪЧ___ЃЌВйзї1ЫљашЕФВЃСЇвЧЦїУћГЦЮЊ___ЁЃ
ЃЈ3ЃЉеєЗЂХЈЫѕLi2SO4ШмвКЕФФПЕФЪЧ___ЁЃ
ЃЈ4ЃЉаДГіКЯГЩЗДгІЕФРызгЗНГЬЪН___ЁЃ
ЃЈ5ЃЉПЦбЇМвЩшМЦвЛжжяЎЕчГиЕФЗДгІдРэЮЊLiFePO4![]() Li+FePO4ЃЌЗХЕчЪБе§МЋЗДгІЪНЮЊ___ЁЃ
Li+FePO4ЃЌЗХЕчЪБе§МЋЗДгІЪНЮЊ___ЁЃ
ЃЈ6ЃЉЙЄвЕЩЯШЁ300ЖжКЌбѕЛЏяЎ5%ЕФІТ-яЎЛдПѓЪЏЃЌОЩЯЪіБфЛЏЕУЕНДПОЛЕФLiFePO4ЙВ110.6ЖжЃЌдђдЊЫияЎЕФРћгУТЪЮЊ___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПXЁЂYЁЂZЁЂWЮЊдзгађЪ§ЕндіЕФЫФжжЖЬжмЦкдЊЫиЃЌдкЭЌжмЦкдЊЫиЕФдзгжаЃЌWЕФАыОЖзюДѓЃЛZЕФдзгађЪ§ЕШгкXЁЂYдзгађЪ§жЎКЭЃЌAЁЂBЁЂCЗжБ№ЮЊXЁЂYЁЂZаЮГЩЕФЖўдЊЛЏКЯЮяЃЌDЁЂMЗжБ№ЮЊYЁЂZдЊЫиаЮГЩЕФЕЅжЪЃЌЯрЛЅзЊЛЏЙиЯЕШчЭМЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ

A.WЁЂZЁЂYЁЂXдЊЫиЕФдзгАыОЖвРДЮМѕаЁ
B.МђЕЅЦјЬЌЧтЛЏЮяЕФЗаЕуZБШWЕФИп
C.ЙЄвЕЩЯПЩгУЕчНтШлШкЕФWдЊЫиТШЛЏЮяжЦБИW
D.ЗЧН№ЪєадЃКY>Z>X
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТЭМЪЧРћгУЗЯЭаМЃЈКЌдгжЪЬњЃЉжЦБИЕЈЗЏЃЈСђЫсЭОЇЬхЃЉЕФСїГЬЁЃ
ВПЗжбєРызгвдЧтбѕЛЏЮяаЮЪНГСЕэЪБШмвКЕФpHМћЯТБэЃК
ГСЕэЮя | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
ПЊЪМГСЕэ | 2.7 | 7.5 | 4.4 |
ЭъШЋГСЕэ | 3.7 | 9.7 | 6.7 |
ЧыЛиД№ЃК
ЃЈ1ЃЉШмвКBжаКЌгаЕФбєРызгга____________________ЃЈЬюРызгЗћКХЃЉЁЃ
ЃЈ2ЃЉЯТСаЮяжЪжазюЪЪвЫзібѕЛЏМСXЕФЪЧ__________ЃЈЬюзжФИЃЉЁЃ
aЃЎNaClO bЃЎH2O2 cЃЎKMnO4
ЃЈ3ЃЉМгШыЪдМСЂйЪЧЮЊСЫЕїНкpHЃЌвЊЕїећpHЗЖЮЇЪЧ_____________ЃЌдђЪдМСЂйПЩвдбЁдё______________ЃЈЬюЛЏбЇЪНЃЉЁЃ
ЃЈ4ЃЉГСЕэDМгШыбЮЫсКЭЬњЗлЃЌПЩвджЦЕУFeCl2ШмвКЃЌЪЕбщЪвБЃДцFeCl2ШмвКЃЌашМгШыЙ§СПЕФЬњЗлЃЌЦфдвђЪЧ____________________________________ЃЈгУРызгЗНГЬЪНБэЪОЃЉЁЃ
ЃЈ5ЃЉШмвКEОЙ§ВйзїЂйПЩЕУЕНЕЈЗЏЃЌВйзїЂйЮЊ________________________ЁЂЙ§ТЫЁЂЯДЕгЁЃ
ЃЈ6ЃЉвбжЊШмвКжаcЃЈCu2+ЃЉгыpHЕФЙиЯЕЮЊlgcЃЈCu2+ЃЉ=8.6-2pHЃЌШєШмвКжаcЃЈCu2+ЃЉЮЊ1mol/LЃЌДЫЪБШмвКжаЕФFe3+ФмЗёГСЕэЭъШЋЃК___________ЃЈЬюЁАФмЁБЛђЁАЗёЁБЃЉ ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛЖЈЬѕМўЯТЃЌЭЈЙ§ЯТСаЗДгІПЩЪЕЯжШМУКбЬЦјжаСђЕФЛиЪеЃКSO2(g)ЃЋ2CO(g)![]() 2CO2(g)ЃЋS(s) ІЄH <0ЁЃШєЗДгІдкКуШнЕФУмБеШнЦїжаНјааЃЌЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧ( )
2CO2(g)ЃЋS(s) ІЄH <0ЁЃШєЗДгІдкКуШнЕФУмБеШнЦїжаНјааЃЌЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧ( )
A.ЦНКтЧАЃЌЫцзХЗДгІЕФНјааЃЌШнЦїФкбЙЧПЪМжеВЛБф
B.ЦНКтЪБЃЌЦфЫћЬѕМўВЛБфЃЌЗжРыГіСђЃЌе§ЗДгІЫйТЪМгПь
C.ЦНКтЪБЃЌЦфЫћЬѕМўВЛБфЃЌЩ§ИпЮТЖШПЩЬсИп SO2ЕФзЊЛЏТЪЃЌЦНКтГЃЪ§діДѓ
D.ЦфЫћЬѕМўВЛБфЃЌЪЙгУВЛЭЌДпЛЏМСЃЌИУЗДгІЕФЦНКтГЃЪ§ВЛБф
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. 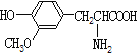 гы
гы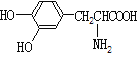 ЖМЪЧІС-АБЛљЫсЧвЛЅЮЊЭЌЯЕЮя
ЖМЪЧІС-АБЛљЫсЧвЛЅЮЊЭЌЯЕЮя
B. CH3CHЃНCHCH3ЗжзгжаЕФЫФИіЬМдзгдкЭЌвЛжБЯпЩЯ
C. АДЯЕЭГУќУћЗЈЃЌЛЏКЯЮяАДЯЕЭГУќУћЗЈЃЌЛЏКЯЮя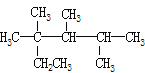 ЕФУћГЦЪЧ2ЃЌ3ЃЌ4-Ш§МзЛљ-2-ввЛљЮьЭщ
ЕФУћГЦЪЧ2ЃЌ3ЃЌ4-Ш§МзЛљ-2-ввЛљЮьЭщ
D. ![]() ЕФвЛфхДњЮяКЭ
ЕФвЛфхДњЮяКЭ![]() ЕФвЛфхДњЮяЖМга4жжЃЈВЛПМТЧСЂЬхвьЙЙЃЉ
ЕФвЛфхДњЮяЖМга4жжЃЈВЛПМТЧСЂЬхвьЙЙЃЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЮТЖШЪБЃЌAg2SO4дкЫЎШмвКжаЕФГСЕэШмНтЦНКтЧњЯпШчЭМЫљЪОЃЌЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ

A. bЕуЖдгІЕФKspЕШгкcЕуЖдгІЕФKsp
B. ВЩШЁеєЗЂШмМСЕФЗНЗЈПЩвдЪЙШмвКДгaЕуБфЕНbЕу
C. ИУЮТЖШЯТЃЌAg2SO4ЕФKspЃН1.6ЁС10Ѓ5
D. 0.02 molЁЄLЃ1ЕФAgNO3ШмвКгы0.2 molЁЄLЃ1ЕФNa2SO4ШмвКЕШЬхЛ§ЛьКЯВЛЛсЩњГЩГСЕэ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com