
【题目】X、Y、Z、W为原子序数递增的四种短周期元素,在同周期元素的原子中,W的半径最大;Z的原子序数等于X、Y原子序数之和,A、B、C分别为X、Y、Z形成的二元化合物,D、M分别为Y、Z元素形成的单质,相互转化关系如图。下列说法正确的是( )

A.W、Z、Y、X元素的原子半径依次减小
B.简单气态氢化物的沸点Z比W的高
C.工业上可用电解熔融的W元素氯化物制备W
D.非金属性:Y>Z>X
【答案】C
【解析】
X、Y、Z、W为原子序数递增的四种短周期元素,在同周期元素的原子中,W的半径最大,则W为Na;Z的原子序数等于X、Y原子序数之和,A、B、C分别为X、Y、Z形成的二元化合物,D、M分别为Y、Z元素形成的单质,相互转化关系如图,根据连续的M,则M为氧气,Z为O,A为氨气,B为NO,C为NO2,D为N2,则X为H,Y为N。
A. 原子半径大小顺序为Na > N > O > H,故A错误;
B. NaH是离子晶体,H2O为分子晶体,因此H2O沸点比NaH的低,故B错误;
C. 工业上可用电解熔融的NaCl制备Na,故C正确;
D. 同周期,从左到右非金属增强,因此非金属性:O > N > H,故D错误。
综上所述,答案为C。


科目:高中化学 来源: 题型:
【题目】下列关于![]() 的说法正确的是
的说法正确的是
A. 所有原子可能都在同一平面上 B. 最多只可能有9个碳原子在同一平面
C. 有7个碳原子可能在同一直线 D. 只可能有5个碳原子在同一直线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(1)中加入CaO,在(2)中不加其他任何物质,在(3)中加入NH4Cl晶体,发现(1)中红棕色变深,(3)中红棕色变浅。[已知反应2NO2(红棕色) N2O4(无色)]

下列叙述正确的是( )
A.2NO2N2O4是放热反应
B.NH4Cl溶于水时放出热量
C.烧瓶(1)中平衡混合气体的平均相对分子质量增大
D.烧瓶(3)中气体的压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中的Ⅰ是某抗肿瘤药物的中间体,B的核磁共振氢谱有3组峰,C的分子式为C7H8O,D分子中有两个相同且处于相邻位置的含氧官能团,E的相对分子质量比D大34.5。
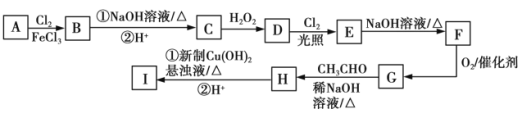
已知:RCHO+R1CH2CHO![]() RCH=C(R1)CHO+H2O。
RCH=C(R1)CHO+H2O。
请回答下列问题:
(1)C的名称是______,B的结构简式为_________,D转化为E的反应类型是____________。
(2)I中官能团的名称为______,I的分子式为________。
(3)写出E转化为F的化学方程式____________。
(4)X是G酸化后的产物,X有多种芳香族同分异构体,符合下列条件且能发生银镜反应的同分异构体有____种(不包括X),写出核磁共振氢谱有4组峰的物质的结构简式____________。
①遇FeCl3溶液发生显色反应 ②苯环上有两种类型的取代基
(5)参照上述流程,以乙醇为原料(其他无机试剂自选)可制取2﹣丁烯酸,写出相应的合成路线__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,在一定温度和压强下于密闭容器中,反应达到平衡时,下列叙述正确的是
CO2(g)+H2(g) ΔH<0,在一定温度和压强下于密闭容器中,反应达到平衡时,下列叙述正确的是
A. 升高温度,K增大B. 减小压强,n(CO2)增大
C. 充入一定量的氮气,n(H2)不变D. 更换高效催化剂,CO的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是生命的基础,近几年科学家们纷纷掀起了研究碳的热潮。回答下列问题:
(1)2019年人们“谈霾色变”,汽车尾气是雾霾的罪魁之一。汽车尾气净化的原理为:2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH<0。
某温度下,恒容的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
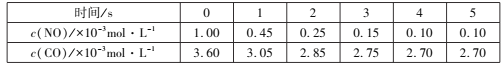
①2s内用N2表示的化学反应速率为___,该温度下,反应的化学平衡常数为___。
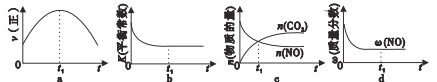
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是___(填代号)。
(2)用CH4催化还原NOx也可以减少氮的污染。
已知:CH4(g)+2NO2(g)= CO2(g)+ N2(g)+2H2O(g) ΔH=867kJ/mol
2NO2(g)=N2O4(g) ΔH=-56.9kJ/mol
H2O(g)=H2O(l) ΔH=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(1)的热化学方程式:___。
(3)常温常压下,测得向水中通入足量的CO2后,水溶液的pH=5.6。
①若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3-+H+的平衡常数K大约为___。(已知:溶液中c(H2CO3)=1.5×10-5 molL1,10-5.6=2.5×10-6)
HCO3-+H+的平衡常数K大约为___。(已知:溶液中c(H2CO3)=1.5×10-5 molL1,10-5.6=2.5×10-6)
②常温下,测得NaHCO3溶液呈碱性,则溶液中c(H2CO3)___c(CO32-)(填“>”“”或“<”),原因是___ (用离子方程式和必要的文字说明)。
③锅炉中的CaSO4沉淀可用可溶性碳酸盐浸取,然后加酸除去,浸取过程中会发生反应:CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq)。
CaCO3(s)+SO42-(aq)。
已知298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为___(计算结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某烧碱样品的纯度(含有的少量可溶性杂质不与酸反应),某同学进行滴定实验。回答下列问题
(1)烧碱样品溶液的配制:用_____(填仪器名称,下同)准确称取烧碱样品wg,用新煮沸并冷却的蒸馏水在_____中溶解,完全溶解并冷却后,全部转移至250mL的_____中并定容。
(2)滴定:
Ⅰ.用移液管(或碱式滴定管)量取25.00mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂;
Ⅱ.将物质的量浓度为mmolL﹣1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度V1mL;
Ⅲ.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2mL
①锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去H2SO4标准溶液的体积_____(填“偏大”“偏小”或“无影响”)。
②步骤Ⅲ的操作中锥形瓶下垫一张白纸的作用是_____。
③步骤Ⅱ中液面应调整到_____,尖嘴部分应_____。
④若酸式滴定管没用标准H2SO4润洗,会对测定结果有何影响_____(填“偏高”“偏低”或“无影响”,其他操作均正确)。
(3)烧碱样品的纯度为_____(用含w、m、V1、V2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一包铝热剂(铝粉和氧化铁的混合物),进行如下实验,①向一份铝热剂中加入800ml 2mol/L的氢氧化钠溶液,使其充分反应后,收集到的气体体积为20.16L(S.T.P.)②另一份等质量的铝热剂在高温下充分反应后,向反应后固体中加入2L 2.5mol/L的盐酸溶液,使固体完全溶解,反应后溶液PH=0(假设过程中溶液体积不变),取少量反应后溶液,滴加硫氰化钾,没有出现血红色.完成下列计算:
(1)计算该铝热剂中铝与氧化铁物质的量之比?_______________
(2)实验②产生的气体的体积是多少?(S.T.P.)______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HClO是比H2CO3还弱的酸,氯水中存在下列平衡:Cl2+H2O![]() HCl+HClO;HClO
HCl+HClO;HClO![]() H++ClO-,达到平衡后,要使HClO的浓度增大,可加入下列物质:
H++ClO-,达到平衡后,要使HClO的浓度增大,可加入下列物质:
A.SO2B.NaHCO3C.HClD.NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com