
����Ŀ��һ�������£�ͨ�����з�Ӧ��ʵ��ȼú��������Ļ��գ�SO2(g)��2CO(g)![]() 2CO2(g)��S(s) ��H <0������Ӧ�ں��ݵ��ܱ������н��У������й�˵����ȷ����( )
2CO2(g)��S(s) ��H <0������Ӧ�ں��ݵ��ܱ������н��У������й�˵����ȷ����( )
A.ƽ��ǰ�����ŷ�Ӧ�Ľ��У�������ѹǿʼ�ղ���
B.ƽ��ʱ�������������䣬�����������Ӧ���ʼӿ�
C.ƽ��ʱ�������������䣬�����¶ȿ���� SO2��ת���ʣ�ƽ�ⳣ������
D.�����������䣬ʹ�ò�ͬ�������÷�Ӧ��ƽ�ⳣ������
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵������ȷ����Ŀ��
��12.0g���ڵ�NaHSO4�к��е���������Ϊ0.2NA
��1mol Na2O ��Na2O2�����������������������3NA
�۳��³�ѹ�£�92g��NO2��N2O4������庬�е�ԭ����Ϊ6NA
��7.8g![]() �к��е�̼̼˫����ĿΪ0.3NA
�к��е�̼̼˫����ĿΪ0.3NA
����1L1.0 mol/LFeCl3��Һ�Ʊ������������壬��������������������ĿΪNA
��1mol SO2������O2��һ�������³�ַ�Ӧ����SO3����ת��2NA������
���ڷ�ӦKIO3+6HI=KI+3I2 +3H2O �У�ÿ����3molI2ת�Ƶĵ�����Ϊ5NA
�ೣ�³�ѹ�£�17 g��(��14CH3)��������������Ϊ9NA
A. 3 B. 4 C. 5 D. 6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�еĢ���ij������ҩ����м��壬B�ĺ˴Ź���������3��壬C�ķ���ʽΪC7H8O��D��������������ͬ�Ҵ�������λ�õĺ��������ţ�E����Է���������D��34.5��
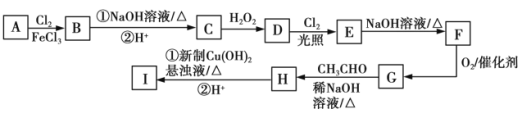
��֪��RCHO+R1CH2CHO![]() RCH=C(R1)CHO+H2O��
RCH=C(R1)CHO+H2O��
��ش��������⣺
(1)C��������______��B�Ľṹ��ʽΪ_________��Dת��ΪE�ķ�Ӧ������____________��
(2)I�й����ŵ�����Ϊ______��I�ķ���ʽΪ________��
(3)д��Eת��ΪF�Ļ�ѧ����ʽ____________��
(4)X��G�ữ��IJ��X�ж��ַ�����ͬ���칹�壬���������������ܷ���������Ӧ��ͬ���칹����____�֣�������X����д���˴Ź���������4�������ʵĽṹ��ʽ____________��
����FeCl3��Һ������ɫ��Ӧ���������ڱ��������������͵�ȡ����
(5)�����������̣����Ҵ�Ϊԭ�ϣ��������Լ���ѡ������ȡ2����ϩ�ᣬд����Ӧ�ĺϳ�·��__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�������Ļ������������ѧ���Ƿ��������о�̼���ȳ����ش��������⣺
��1��2019��������̸��ɫ����������β�������������֮һ������β��������ԭ��Ϊ��2NO(g)+2CO(g)=2CO2(g)+N2(g) ��H��0��
ij�¶��£����ݵ��ܱ�������ͨ��NO��CO����ò�ͬʱ���NO��CO��Ũ�����±���
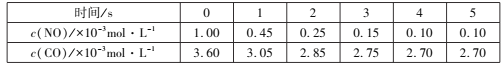
��2s����N2��ʾ�Ļ�ѧ��Ӧ����Ϊ___�����¶��£���Ӧ�Ļ�ѧƽ�ⳣ��Ϊ___��
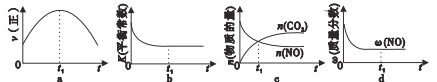
�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬����___(�����)��
��2����CH4����ԭNOxҲ���Լ��ٵ�����Ⱦ��
��֪��CH4(g)+2NO2(g)= CO2(g)+ N2(g)+2H2O(g) ��H=867kJ/mol
2NO2(g)=N2O4(g) ��H=-56.9kJ/mol
H2O(g)=H2O(l) ��H=-44.0kJ/mol
д��CH4����ԭN2O4(g)����N2��H2O��1�����Ȼ�ѧ����ʽ��___��
��3�����³�ѹ�£������ˮ��ͨ��������CO2��ˮ��Һ��pH=5.6��
��������ˮ�ĵ��뼰H2CO3�ĵڶ������룬��H2CO3![]() HCO3-+H+��ƽ�ⳣ��K��ԼΪ___��(��֪����Һ��c(H2CO3)=1.5��10-5 molL1��10-5.6=2.5��10-6)
HCO3-+H+��ƽ�ⳣ��K��ԼΪ___��(��֪����Һ��c(H2CO3)=1.5��10-5 molL1��10-5.6=2.5��10-6)
�������£����NaHCO3��Һ�ʼ��ԣ�����Һ��c(H2CO3)___c(CO32-)(����>����������<��)��ԭ����___ (�����ӷ���ʽ�ͱ�Ҫ������˵��)��
����¯�е�CaSO4�������ÿ�����̼���ν�ȡ��Ȼ������ȥ����ȡ�����лᷢ����Ӧ��CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq)��
CaCO3(s)+SO42-(aq)��
��֪298Kʱ��Ksp(CaCO3)=2.80��10-9��Ksp(CaSO4)=4.90��10-5������¶��¸÷�Ӧ��ƽ�ⳣ��KΪ___(������������λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˲ⶨij�ռ���Ʒ�Ĵ��ȣ����е��������������ʲ����ᷴӦ����ijͬѧ���еζ�ʵ�顣�ش���������
��1���ռ���Ʒ��Һ�����ƣ���_____�����������ƣ���ͬ��ȷ��ȡ�ռ���Ʒwg��������в���ȴ������ˮ��_____���ܽ⣬��ȫ�ܽⲢ��ȴ��ȫ��ת����250mL��_____�в����ݡ�
��2�����
������Һ�ܣ����ʽ�ζ��ܣ���ȡ25.00mL�ռ���Һ����ƿ�в��Ӽ��μ���ָʾ����
�����ʵ���Ũ��ΪmmolL��1�ı�H2SO4��Һװ����ʽ�ζ��ܣ�����Һ�棬���¿�ʼ�̶�V1mL��
������ƿ�µ�һ�Ű�ֽ���ζ����յ㣬��¼�յ�̶�ΪV2mL
����ƿ������ˮϴ�Ӻ�ˮδ��������ζ�ʱ��ȥH2SO4����Һ�����_____���ƫ��ƫС������Ӱ�족����
�ڲ����IJ�������ƿ�µ�һ�Ű�ֽ��������_____��
�۲������Һ��Ӧ������_____�����첿��Ӧ_____��
������ʽ�ζ���û�ñ�H2SO4��ϴ����Բⶨ����к�Ӱ��_____���ƫ�ߡ���ƫ�͡�����Ӱ�족��������������ȷ����
��3���ռ���Ʒ�Ĵ���Ϊ_____���ú�w��m��V1��V2�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ߵ��߲ˣ�������ȡ������A�������õı������ܺ�ҩ�ü�ֵ��A�Ľṹ��ͼ�����й���A�����������ȷ����
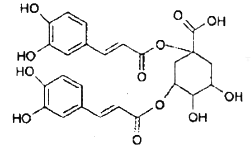
A.A�����������¿��Է���ˮ�ⷴӦ
B.1mol A������NaOH��Һ��Ӧ���������9mol NaOH
C.A�ܺ�Ũ��ˮ�����ӳɺ�ȡ����Ӧ
D.A��4�ֹ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�����ȼ������ۺ��������Ļ�������������ʵ�飬����һ�����ȼ��м���800ml 2mol/L������������Һ��ʹ���ַ�Ӧ���ռ������������Ϊ20.16L��S��T��P��������һ�ݵ����������ȼ��ڸ����³�ַ�Ӧ����Ӧ������м���2L 2.5mol/L��������Һ��ʹ������ȫ�ܽ⣬��Ӧ����ҺPH=0�������������Һ������䣩��ȡ������Ӧ����Һ���μ����軯�أ�û�г���Ѫ��ɫ��������м��㣺
��1����������ȼ����������������ʵ���֮�ȣ�_______________
��2��ʵ��ڲ��������������Ƕ��٣���S��T��P����______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���÷���м�Ʊ����Խ������ӣ���ȡ�������£�

����˵������ȷ����
A. ��Na2CO3��Һ������Ϊ�˳�ȥ����м���������
B. ͨ��N2�Ƿ�ֹ�����е�O2����������Ԫ��
C. ��������H2O2��Ϊ�˽�����Fe2+����ΪFe3+���漰��Ӧ��H2O2+2Fe2++2H+=2Fe3++2 H2O
D. ��ҺA��Fe2+��Fe3+��Ũ�ȱ�Ϊ2:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ��һ������Ӫ��ǿ����������ˮ�ܿ�[��Ҫ�ɷ�Ϊ
��һ������Ӫ��ǿ����������ˮ�ܿ�[��Ҫ�ɷ�Ϊ![]() ������������
������������![]() ��]��ȡ���乤���������£�
��]��ȡ���乤���������£�
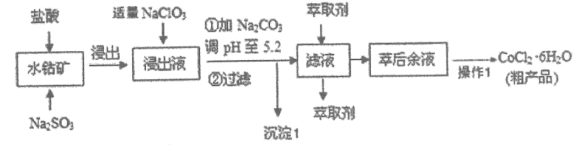
��֪��a������Һ�к��е���������Ҫ��![]() �ȡ�
�ȡ�
b�������в���������������������ʽ����ʱ��Һ��![]() ���±���
���±���
������ |
|
|
|
|
|
��ʼ���� | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
��ȫ���� | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
�ش��������⣺
(1)����ˮ�ܿ�����У�![]() ������Ӧ�����ӷ���ʽΪ_____________________��
������Ӧ�����ӷ���ʽΪ_____________________��
(2)�����Һ�м�������![]() ��Ŀ����_______________________��
��Ŀ����_______________________��
(3)���������г���1����Ҫ�ɷ�Ϊ________________(�ѧʽ)��
(4)��ȡ���Խ������ӵ���ȡ������Һ![]() �Ĺ�ϵ��ͼ��ʾ������Һ���м������ȡ����Ŀ����__________��ʹ�ø���ȡ�������
�Ĺ�ϵ��ͼ��ʾ������Һ���м������ȡ����Ŀ����__________��ʹ�ø���ȡ�������![]() ��Χ��_______(��ѡ����ĸ)��
��Χ��_______(��ѡ����ĸ)��
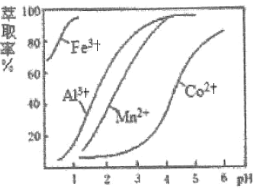
A��![]() B��
B��![]() C��
C��![]() D��
D��![]()
(5)���������С�����1��Ϊ__________��_________�����˺�����ˮ�Ҵ�ϴ�Ӻ�������ˮ�Ҵ�ϴ�ӵ�Ŀ����__________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com