
【题目】我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如图: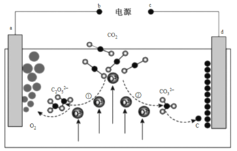
下列说法不正确的是( )
A.b为电源的负极
B.①②中,捕获CO2时碳元素的化合价发生了变化
C.a极的电极反应式为2C2O52﹣-4e﹣=4CO2+O2
D.上述装置存在反应:CO2![]() C+O2
C+O2
科目:高中化学 来源: 题型:
【题目】随着环保意识增强,清洁能源越来越受到人们关注。
(1)甲烷是一种理想的洁净燃料。已知:CH4(g)+2O2(g)= CO2(g)+ 2H2O(g);△H= -802.3kJ·mol-1 H2O(1)=H2O(g),△H =+44.0kJ·mol-l
写出常温常压下甲烷完全燃烧的热化学方程式____,计算4.8g甲烷气体完全燃烧生成液态水,放出热量为____kJ。
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值。该反应为CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H=+206.lkJ·mol-l。
CO(g)+3H2(g)△H=+206.lkJ·mol-l。
①800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表。
CH4 | H2O | CO | H2 |
3.0 molL1 | 8.5 molL1 | 2.0 molL1 | 2.0 molL1 |
则此时正、逆反应速率的关系是正反应速率____逆反应速率。(填“>”、“<”、“=”)
②为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101 kPa或303 kPa,其余实验条件见下表)。
实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/ molL1 | H2O初始浓度/ molL1 |
1 | 360 | p | 2.00 | 6.80 |
2 | t | 101 | 2.00 | 6.80 |
3 | 360 | 101 | 2.00 | 6.80 |
表中t=___,P=____;设计实验2、3的目的是____;实验l、2、3中反应的化学平衡常数的大小关系是____(用K1、K2、K3表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据等电子原理,由短周期元素组成的粒子,只要其电子总数相同,均可互称为等电子体。等电子体之间结构相似,物理性质也相近。以下各组粒子能互称为等电子体的是( )
A. O3和SO2 B. CO和N2 C. CO和NO D. N2H4 和C2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四组物质,用横线上所给的试剂常温下就能鉴别出来的是( )
A.FeO、FeS、CuO、CuS、稀硫酸
B.苯、四氯化碳、无水乙醇、己烯 溴水
C.甲酸、乙酸、乙醛、乙醇 新制氢氧化铜悬浊液
D.苯酚钠溶液、甲苯、乙酸乙酯、乙酸 饱和碳酸钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂因其重要的用途,被誉为“能源金属”和“推动世界前进的金属”.
(1)Li3N可由Li在N2中燃烧制得.取4.164g 锂在N2中燃烧,理论上生成Li3N__g;因部分金属Li没有反应,实际反应后固体质量变为6.840g,则固体中Li3N的质量是__g(保留三位小数,Li3N的式量:34.82)
(2)已知:Li3N+3H2O→3LiOH+NH3↑.取17.41g纯净Li3N,加入100g水,充分搅拌,完全反应后,冷却到20℃,产生的NH3折算成标准状况下的体积是__L.过滤沉淀、洗涤、晾干,得到LiOH固体26.56g,计算20℃时LiOH的溶解度__.(保留1位小数,LiOH的式量:23.94)
锂离子电池中常用的LiCoO2,工业上可由碳酸锂与碱式碳酸钴制备.
(3)将含0.5molCoCl2的溶液与含0.5molNa2CO3的溶液混合,充分反应后得到碱式碳酸钴沉淀53.50g;过滤,向滤液中加入足量HNO3酸化的AgNO3溶液,得到白色沉淀143.50g,经测定溶液中的阳离子只有Na+,且Na+有1mol;反应中产生的气体被足量NaOH溶液完全吸收,使NaOH溶液增重13.20g,通过计算确定该碱式碳酸钴的化学式__,写出制备碱式碳酸钴反应的化学方程式__.
(4)Co2(OH)2CO3和Li2CO3在空气中保持温度为600~800℃,可制得LiCoO2,已知: 3Co2(OH)2CO3+O2→2Co3O4+3H2O+3CO2;4Co3O4+6Li2CO3+O2→12LiCoO2+6CO2
按钴和锂的原子比1:1混合固体,空气过量70%,800℃时充分反应,计算产物气体中CO2的体积分数__.(保留三位小数,已知空气组成:N2体积分数0.79,O2体积分数0.21)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是合成芳香族有机高聚物P的合成路线。
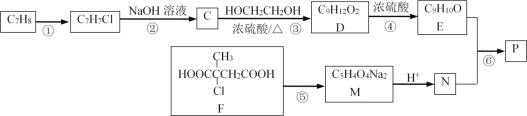
已知:ROH+ R’OH![]() ROR’ + H2O
ROR’ + H2O
完成下列填空:
(1)F中官能团的名称_____________________;写出反应①的反应条件______;
(2)写出反应⑤的化学方程式______________________________________________。
(3)写出高聚物P的结构简式__________。
(4)E有多种同分异构体,写出一种符合下列条件的同分异构体的结构简式______。
①分子中只有苯环一个环状结构,且苯环上有两个取代基;
②1mol该有机物与溴水反应时消耗4molBr2
(5)写出以分子式为C5H8的烃为主要原料,制备F的合成路线流程图(无机试剂任选)。合成路线流程图示例如:![]() ____________________
____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二烯烃是有机化工中的重要物质,分子中存在单双键交替出现的结构称为共轭结构,含共轭结构的多烯烃称为共轭烯烃。完成下列填空:
(1)下列物质中不含有共轭结构的是______。(填编号)
a.![]()
b.![]()
c.![]()
d.CH3CH2CH=CH2
(2)共轭二烯烃的加成位置有多种可能,天然橡胶的单体与溴反应的产物可能有_______种。
(3)共轭二烯及其衍生物可以与含碳碳双键、叁键的化合物进行加成。例如:

则要制备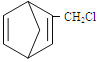 ,含共轭结构的原料可以是___________。(写结构简式)
,含共轭结构的原料可以是___________。(写结构简式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃通过催化加氢后得到2-甲基丁烷,该烃不可能是( )
A. 3-甲基-1-丁炔B. 2-甲基-1-丁炔
C. 3-甲基-1-丁烯D. 2-甲基-1-丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】血红蛋白(Hb)和肌红蛋白(Mb)分别存在于血液和肌肉中,都能与氧气结合,与氧气的结合度a(吸附O2的Hb或Mb的量占总Hb或Mb的量的比值)和氧气分压p(O2)密切相关。请回答下列问题:
(1)人体中的血红蛋白(Hb)能吸附O2、H+,相关反应的热化学方程式及平衡常数如下:
Ⅰ.Hb(aq)+H+(aq)![]() HbH+(aq) ΔH1 K1
HbH+(aq) ΔH1 K1
Ⅱ.HbH+(aq)+O2(g)![]() HbO2(aq)+H+(aq) ΔH2 K2
HbO2(aq)+H+(aq) ΔH2 K2
Ⅲ.Hb(aq)+O2(g)![]() HbO2(aq) ΔH3 K3
HbO2(aq) ΔH3 K3
ΔH3=_____(用ΔH1、ΔH2表示),K3=_____(用K1、K2表示)。
(2)Hb与氧气的结合能力受到c(H+)的影响,相关反应如下:HbO2(aq)+H+(aq)![]() HbH+(aq)+O2(g)。37 ℃,pH分别为7.2、7.4、7.6时氧气分压p(O2)与达到平衡时Hb与氧气的结合度
HbH+(aq)+O2(g)。37 ℃,pH分别为7.2、7.4、7.6时氧气分压p(O2)与达到平衡时Hb与氧气的结合度![]() 的关系如图1所示,pH=7.6时对应的曲线为_____(填“A”或“B”)。
的关系如图1所示,pH=7.6时对应的曲线为_____(填“A”或“B”)。
(3)Mb与氧气结合的反应如下:Mb(aq)+O2(g)![]() MbO2(aq) ΔH,37 ℃时,氧气分压p (O2)与达平衡时Mb与氧气的结合度a的关系如图2所示。
MbO2(aq) ΔH,37 ℃时,氧气分压p (O2)与达平衡时Mb与氧气的结合度a的关系如图2所示。

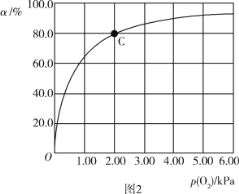
①已知Mb与氧气结合的反应的平衡常数的表达式K=![]() ,计算37 ℃时K=_____kPa-1。
,计算37 ℃时K=_____kPa-1。
②人正常呼吸时,体温约为37 ℃,氧气分压约为20.00 kPa,计算此时Mb与氧气的最大结合度为______(结果保留3位有效数字)。
③经测定,体温升高,Mb与氧气的结合度降低,则该反应的ΔH____(填“>”或“<”)0。
④已知37 ℃时,上述反应的正反应速率v(正)=k1·c(Mb)·p(O2),逆反应速率v(逆)=k2·c(MbO2),若k1=120 s-1·kPa-1,则k2=______。37 ℃时,图2中C点时,![]() =____。
=____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com