
【题目】随着卤族元素原子序数递增,下列说法正确的是( )
A. 单质的氧化性逐渐减弱 B. 单质的熔、沸点逐渐降低
C. 单质的密度逐渐降低 D. 气态氢化物的稳定性逐渐增强
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数值,下列说法正确的是
A. 室温下,21.0g 乙烯与丙烯的混合气体中含有的碳原子数为1.5NA
B. 常温常压下,0.1molC8H18所含有的共价键数目为2.0 NA
C. 0.1mol乙醇与氧气完全反应生成二氧化碳时转移电子数为0.1NA
D. 标准状况下,2.24L乙酸乙酯中所含氧原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是( )
A. 室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++2H2O===NH3·H2O+H3O+
B. 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O===2AlO2-+3H2↑
C. 用碳酸氢钠溶液检验水杨酸中的羧基: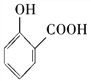 +2HCO3-→
+2HCO3-→ +2H2O+2CO2↑
+2H2O+2CO2↑
D. 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O4-=2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)① ![]() 的系统命名:_______________。
的系统命名:_______________。
②CH3CH2CHO的银镜反应的化学方程式:_____________________。
(2)有机物A的结构简式为![]() ,它可通过不同化学反应分别制得B、C、D和E 四种物质。
,它可通过不同化学反应分别制得B、C、D和E 四种物质。

请回答下列问题:
(1)指出反应的类型:A→C:_______________ 。
(2)在A~E五种物质中,互为同分异构体的是_______________(填代号)。
③己知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是____________(填代号)。
④ C能形成高聚物.该高聚物的结构简式为:__________________。
⑤ 写出D与NaOH溶液共热反应的化学方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 标准状况下,11.2 L水中含有的分子数是0.5NA
B. 常温常压下,17g氨气中所含原子数为NA
C. 1 mol OH- 中含有电子数为10NA
D. 1 mol/LBaCl2溶液中含有的氯离子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在2 L固定容积的密闭容器中发生反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列正确的是:
4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列正确的是:

A. 0-20 s内平均反应速率v(N2O5)=0.1 mol·L-1·s-1
B. 10 s时,正、逆反应速率相等,达到平衡
C. 20 s时,正反应速率大于逆反应速率
D. 曲线a表示NO2的物质的量随反应时间的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用.
(1)下列有关实验的叙述,正确的是_______.
(A)配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶
(B)用渗析法分离淀粉中混有的NaCl杂质
(C)无法用分液漏斗将甘油和水的混合液体分离
(D)用酸式滴定管量取20. 00mL高锰酸钾溶液
(E)为了测定某溶液的pH,将经水润湿的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
(F)用浓氨水洗涤做过银镜反应的试管
(G)配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
(H)配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
(J)在氢氧化铁胶体中加少量硫酸会产生沉淀
(K)用结晶法可以除去硝酸钾中混有的少量氯化钠
(2)如图为常见仪器的部分结构(有的仪器被放大):
A图中液面所示溶液的体积为__________mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为NmL,仰视时读数为MmL,若M>N,则所使用的仪器是___________(填字母标号)。
(3)下图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
盐酸
分子式:HCl
相对分子量: 36.5
密度:1.2g/ml
HCl质量分数:36.5%
①该浓盐酸中HCl的物质的量浓度为_________mol/L。
②某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.3 mol/L稀盐酸。
Ⅰ.该学生需要量取________mL上述浓盐酸进行配制。
II.在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏高的是______。
A.用量筒量取浓盐酸时俯视观察凹液面
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.定容时仰视刻度线
D.在配罝前用已知浓度的稀盐酸润洗容量瓶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com