
����Ŀ��X��Y��Z��M��G����Ԫ�ط������������ڣ���ԭ��������������X��Zͬ���壬���γ����ӻ�����ZX��Y��Mͬ���壬���γ�MY2��MY3���ַ��ӡ��ش��������⣺
��1�� Y��Ԫ�����ڱ��е�λ��Ϊ_____________________________.
��2�� ����Ԫ�ص�����������Ӧ��ˮ����������ǿ����_____________________ (д��ѧʽ)���ǽ�����̬�⻯�ﻹԭ����ǿ����_______________(д��ѧʽ)��
��3�� Y��G�ĵ��ʻ���Ԫ��֮���γɵĻ��������ˮ����������__________________ (д�������������ʵĻ�ѧʽ))��
��4�� ZX�ĵ���ʽΪ_________________��ZX��ˮ��Ӧ�ų�����Ļ�ѧ����ʽΪ__________________��
��5�� ����״̬�£�Z�ĵ��ʺ�FeG2����ɿɳ����(װ��ʾ��ͼ����)���ŵ�ʱ����ص�������Ӧ 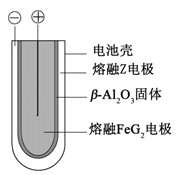
���𰸡���1��Y��2����VIA
��2��HClO4; H2S
��3��O3��Cl2��ClO2��ȡ����������ֶ��ɣ�
��4��![]() ��
��![]()
��5��![]() ��
��
�����������������X��Y��Z��M��G��������Ԫ�ط������������ڣ���ԭ������������������X��HԪ�أ�X��Zͬ���壬���γ����ӻ�����ZX����Zԭ����������Yԭ������������Z��NaԪ�أ�Y��Mͬ���壬���γ�MY2��MY3���ַ��ӣ�����Y��OԪ�أ�M��SԪ�أ�G�Ƕ���������Ԫ�أ�����G��ClԪ�أ�
��1��YΪOԪ�أ���Ԫ�����ڱ��е�λ��Ϊ���ڶ����ڵ���A����2������Ԫ�ص�����������Ӧ��ˮ����������ǿ����HClO4��SԪ�طǽ������������ǽ�����̬�⻯�ﻹԭ����ǿ����H2S��
��3��Y��G�ĵ��ʻ���Ԫ��֮���γɵĻ��������ˮ���������У�Cl2��O3��ClO2�ȣ�
��4�� ZXΪNaH�������ӻ��������ʽΪ![]() ��NaH��ˮ��Ӧ�ų�����Ļ�ѧ����ʽΪ��NaH+H2O=NaOH+H2����
��NaH��ˮ��Ӧ�ų�����Ļ�ѧ����ʽΪ��NaH+H2O=NaOH+H2����
��5�� ����״̬�£�Fe�ĵ��ʺ�FeG2����ɿɳ���أ�Fe�Ǹ������ŵ�ʱ����ص�����������ԭ��Ӧ���缫����ʽ��![]() ��
��


 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A��M����ͼ��ʾת����ϵ��A��F����������̼ԭ������ͬ���Ҿ�����NaHCO3��Һ��Ӧ��F�ķ���ʽΪC9H10O2���Ҳ���ʹ���CCl4��Һ��ɫ��D�ܷ���������Ӧ��M��������NaOH��Һ��Ӧ��IJ����һ�ȴ���ֻ��һ�֡�
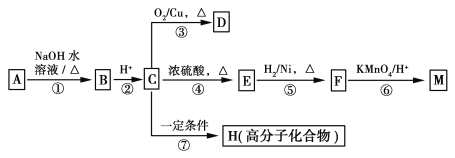
��֪�� (R1��R2��ʾ��������ԭ��)
(R1��R2��ʾ��������ԭ��)
��ش�
��1��B�Ľṹ��ʽΪ________________________��
��2����Ӧ�������У�����������Ӧ����________(�Ӧ���)��
��3��д����Ӧ���Ļ�ѧ����ʽ______________________________________________��
��4��D������Cu(OH)2����Һ��Ӧ�Ļ�ѧ����ʽΪ______________________________��
��5��A����Է���������180��260֮�䣬������ת���в���ȷ��A�е�ijһ�����ţ�����ȷ���ù����ŵ���Щʵ�鷽������ȷ��________��
a��ȡ����A���Թ��У��ټ��뱽���۲��Һ���ϲ���Һ��ɫ
b��ȡ����A���Թ��У��ټ���NaOH��Һ���ȣ�����ȴ�����ϡ������������ԣ�������AgNO3��Һ���۲������ɫ
c��ȡ����A���Թ��У��ٵ���AgNO3��Һ���ټ���ϡ���ᣬ�۲������ɫ
d��ȡ����A���Թ��У��ټ���NaOH�Ĵ���Һ���ȣ�����ȴ�����ϡ������������ԣ�������AgNO3��Һ���۲������ɫ
��6����������������F��ͬ���칹�干��________�֡�
a���ܷ���������Ӧ
b������FeCl3��Һ������ɫ��Ӧ
c���˴Ź������������ĸ��壬������֮��Ϊ1��1��2��6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ����գ�
��1������ϩ��ȡ����ϩ�Ļ�ѧ���̣�_______________��
��2��д���������ʵĽṹ��ʽ��
��2��3-��������____________________________________
��3-��-2-��ϩ___________________________________
������ױ�____________________________
��3�������к���5��̼ԭ�ӵ���״��Ȳ���ķ���ʽ__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£��������ϩ�����Ʊ�������(C2H5Cl)���Իش�
��1�����������Ʊ�������ķ����У�__________________________________�����á�ԭ����________��
��2����д���õ��Ʊ�������(C2H5Cl)�Ļ�ѧ����ʽ______________________________;�÷�Ӧ��������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2��5-���ǻ�����������׳������������������������״������õ����Ǻϳ���ҩ�еij����м��塣��ṹ����ͼ��ʾ��
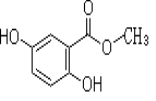
�ش��������⣺
��1�������������������������Ϊ _________________
��2������������ķ���ʽΪ________________
��3�������й��������������������ȷ����______________(����ĸ)��
a���ܷ�����ȥ��Ӧ
b���������������ӳɷ�Ӧ
c������Ũ��ˮ��Ӧ
��4���������������������������Һ��Ӧ�Ļ�ѧ����ʽ___________________ ��
��5��д����������������������������ͬ���칹��Ľṹ��ʽ_________��____________��
�� �ܷ���������Ӧ�� �� ��ʹFeCl3��Һ��ɫ��
�� ���� �������ϵ�һ�ȴ���ֻ������
��6����֪X�����������л����������ת����ϵ���Ҳ��C4H8����һ��֧����A�ĺ˴Ź�������ͼ�����������շ塣
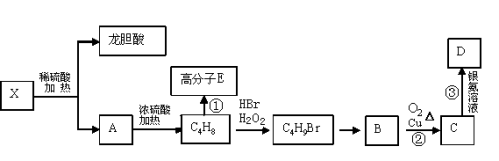
д�����Ļ�ѧ����ʽ____________________________________��
���Ļ�ѧ����ʽ______________________________________��
����ѧ����ʽ ________________________________________��
д��X�Ľṹ��ʽ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯������100mLϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų���������ʵ���¼���£��ۼ�ֵ����

��1�� ��һʱ��Σ�ָ��0��1����1��2����2��3����3��4����4��5 min����ͬ����Ӧ������� ��������ţ���ͬ�� ��ԭ���� ��
��2�� ��һ��ʱ�εķ�Ӧ������С ��ԭ���� ��
��3�� ��2��3����ʱ����������Ũ�ȱ仯����ʾ�ĸ÷�Ӧ���ʣ�����Һ������䣬��Ҫ��д��������̣� ��
��4�� �����Ӧ̫���ң�Ϊ�˼�����Ӧ���ʶ��ֲ����ٲ����������������������зֱ����������������Һ��[A.����ˮ B.NaCl��Һ C Na2CO3��Һ D.CuSO4��Һ
����Ϊ���е��ǣ����ţ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС�������һ��ʵ����֤Ԫ�������ɡ�
(��)��ͬѧ��a��b��c��ֻ�ձ���ֱ����50 mLˮ,�ٷֱ�μӼ��η�̪��Һ,���μ����С�����ﮡ��ơ��ؿ�,�۲�����
��ͬѧ���ʵ���Ŀ���� , �ձ� (����ĸ)�еķ�Ӧ����ҡ�
(��)��ͬѧ���ʵ����֤�ǽ���Ԫ�صķǽ�����Խǿ,��Ӧ����ۺ���������Ծ�Խǿ�����������ͼװ������֤����̼����Ԫ�صķǽ�����ǿ����
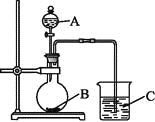
��ͬѧ��Ƶ�ʵ���ֱ��֤�������������ǿ��,��֪A��ǿ��,�����¿���ͭ��Ӧ;B�ǿ�״����;��Һ©���Ļ�����,C�пɹ۲쵽�а�ɫ�������ɡ�
��1��д����ѡ�����ʵĻ�ѧʽ:A: ;B: ; C: ��
��2��д���ձ��з�����Ӧ�����ӷ���ʽ:
��3����װ�ô�����ij��ȱ�ݣ��Ľ��ķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣����е���ĸ�ֱ����һ��Ԫ�ء�
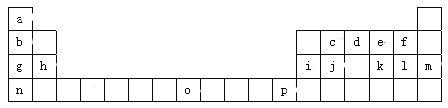
�Իش��������⣺����дʱ�ö�ӦԪ�ط��Ż����ʵĻ�ѧʽ��
��1��f��g��l�ļ����ӵİ뾶��С�����˳���� ��
��2��ԭ��Znλ�����ڱ��е� ����Ԫ��o�����ڱ��е�λ���� ��Ԫ��o�Ķ��������ӵĺ�������Ų�ʽ�� ��
��3�������±���ʾԭ�������ܵ����ݷ������ش�
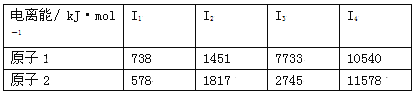
ԭ��2��Ӧ���ڱ���Ԫ���� ��ԭ��1�ĵ�һ�����ܸ���ԭ��2��ԭ���� ��
��4�����ڱ�����ʾ��ԭ�Ӷ�Ӧ����������ˮ���������ǿ���� ����ˮ����Ļ�ѧʽ����ͬ����������ǿ���� ��д��������ǿ��ˮ������Al(OH)3��Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ЧӦ����Դ��ȱ����������ӣ���ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2�������˸������ձ����ӡ�Ŀǰ��ҵ����һ�ַ�������CO2������ȼ�ϼ״���Ϊ̽����Ӧԭ�����ֽ�������ʵ�飬�����Ϊ1 L���ܱ������У�����lmol CO2��3mol H2��һ�������·�����Ӧ��CO2��g��+3H2(g) ![]() CH3OH(g)+H2O(g) ��H = ��49.0kJ��mo1�����CO2��CH3OH��g����Ũ����ʱ��仯��ͼ��ʾ��
CH3OH(g)+H2O(g) ��H = ��49.0kJ��mo1�����CO2��CH3OH��g����Ũ����ʱ��仯��ͼ��ʾ��
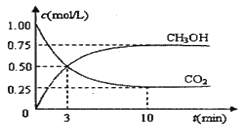
��1���ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v��H2��= mol/��L��min��
��2���÷�Ӧ��ƽ�ⳣ��Ϊ ��
��3�����д�ʩ����ʹn��CH3OH����n��CO2��������� ��
A�������¶� B������He��g����ʹ��ϵѹǿ����
C����H2O(g)����ϵ�з��� D���ٳ���lmol CO2��3mol H2
��4����֪�ڳ��³�ѹ�£�
��2CH3OH��1��+3O2��g��=2CO2��g��+4H2O��g�� ��H= ��1275.6kJ/mol
��H2O��g��=H2O��1�� ��H= ��44.0kJ/mol
��״���ȼ���Ȼ�ѧ����ʽΪ�� ��
��5�����ȼ�ռ״�����ɴ�����ѧ����ʧ������Լ״��Ϳ���Ϊԭ�ϣ�����������Ϊ�������Һ��Ƴ�ԭ��ؽ��кܶ��ŵ㣬����д���õ�صĸ�����Ӧ��___________________
��6�������£�ijˮ��ҺM�д��ڵ������У�Na+��A����H+��OH����������ҺM�� pH=3��HA��Һ![]() mL��pH=11��NaOH��Һ
mL��pH=11��NaOH��Һ![]() mL��Ϸ�Ӧ���ã�������˵������ȷ���� __��
mL��Ϸ�Ӧ���ã�������˵������ȷ���� __��
A������ҺM�����ԣ�����ҺM��c��H+��+c��OH����=2��10��7mol��L-1
B����V1=V2������ҺM��pHһ������7
C������ҺM�����ԣ���V1һ������V2
D������ҺM�ʼ��ԣ���V1һ��С��V2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com