
【题目】向13.6g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.25 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入0.5 mol/L的NaOH溶液1 L,反应后溶液恰好呈中性,金属离子已完全沉淀,沉淀质量为19.6 g,下列说法不正确的是
A.Cu与Cu2O的物质的量之比为2∶1
B.硝酸的物质的量浓度为2 mol/L
C.Cu、Cu2O与硝酸反应后剩余HNO3的物质的量为0.5 mol
D.产生的NO在标准状况下的体积为2.24 L
【答案】BC
【解析】
向所得溶液中加入0.5 mol/L的NaOH溶液1 L,溶液呈中性,金属离子已完全沉淀,此时溶液中溶质为NaNO3,n(NaNO3)=n(NaOH)=0.5 mol/L×1 L=0.5 mol,沉淀为Cu(OH)2,质量为19.6 g,其物质的量n[Cu(OH)2]=![]() =0.2 mol,根据铜元素守恒有n(Cu)+2n(Cu2O)=n[Cu(OH)2],所以反应后的溶液中n[Cu(NO3)2]=n[Cu(OH)2]=0.2 mol。
=0.2 mol,根据铜元素守恒有n(Cu)+2n(Cu2O)=n[Cu(OH)2],所以反应后的溶液中n[Cu(NO3)2]=n[Cu(OH)2]=0.2 mol。
A.设Cu和Cu2O的物质的量分别为x mol、y mol,根据二者质量有64x+144y=13.6,根据铜元素守恒有x+2y=0.2,联立方程解得x=0.1,y=0.05,则:n(Cu):n(Cu2O)=0.1 mol:0.05 mol=2:1,A正确;
B.根据N元素守恒可知n(HNO3)=n(NO)+n(NaNO3),根据电子转移守恒可知:3n(NO)=2 n(Cu)+2n(Cu2O),所以3n(NO)=2×0.1 mol+2×0.05 mol,解得n(NO)=0.1 mol,根据Na元素可知n(NaNO3)=n(NaOH)=0.5 mol/L×1 L=0.5 mol,所以n(HNO3)=n(NO)+n(NaNO3)=0.1 mol+0.5 mol=0.6 mol,所以原硝酸溶液的浓度c(HNO3)=![]() =2.4 mol/L,B错误;
=2.4 mol/L,B错误;
C.反应后的溶液中加入NaOH溶液,NaOH与Cu(NO3)2反应,剩余的NaOH与HNO3反应,最后为NaNO3溶液,根据氮元素守恒可知反应后溶液中n(HNO3)+2n[Cu(NO3)2]= n(NaNO3),所以n(HNO3)= n(NaNO3)-2n[Cu(NO3)2]=0.5 mol-2×0.2 mol=0.1 mol,C错误;
D.由B中计算可知n(NO)=0.1 mol,所以标准状况下NO的体积V(NO)=0.1 mol×22.4 L/mol=2.24 L,D正确;
故合理选项是BC。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物
质的量变化如图-1所示;若保持其他条件不变,温度分别为T1和T2,Y的体积百分含量与时间的关系如图-2所示。下列分析正确的是
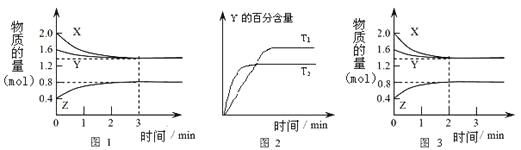
A.容器中发生的反应可表示为:3X(g)+Y(g)![]() 2Z(g)
2Z(g)
B.0~3 min内,v(X)=0.2 molL-1min-1
C.其他条件不变升高温度,v正、v逆都增大,且重新平衡前v正>v逆
D.若改变条件,使反应进程如图-3所示,则改变的条件可能是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
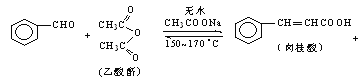 CH3COOH
CH3COOH
药品物理常数
苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
溶解度(25℃,g/100g水) | 0.3 | 遇热水水解 | 0.04 | 互溶 |
沸点(℃) | 179.6 | 138.6 | 300 | 118 |
填空:
合成:反应装置如图所示.向三颈烧瓶中先后加入研细的无水醋酸钠、苯甲醛和乙酸酐,振荡使之混合均匀. 在150~170℃加热1小时,保持微沸状态.
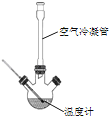
(1)空气冷凝管的作用是__.
(2)该装置的加热方法是__.加热回流要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是______.
(3)不能用醋酸钠晶体(CH3COONa3H2O)的原因是______.
粗品精制:将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:
反应混合物![]()
![]()
![]()
![]()
![]() 肉桂酸晶体
肉桂酸晶体
(4)加饱和Na2CO3溶液除了转化醋酸,主要目的是_______.
(5)操作I是__;若所得肉桂酸晶体中仍然有杂质,欲提高纯度可以进行的操作是__(均填操作名称).
(6)设计实验方案检验产品中是否含有苯甲醛_______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某有机物分子中C、H、O、N四种原子的成键方式示意图(短线表示单键或者双键)。下列关于该有机物的说法正确的是
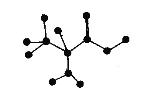
A.在一定条件下,可以通过聚合反应生成高分子化合物
B.分子式为C3H6NO2
C.能和NaOH溶液反应,但不能和盐酸溶液反应
D.不能和NaHCO3溶液反应生成CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监测显示,某地市的主要气体污染物为SO2、NOx、CO等,其主要来源为燃煤、机动车尾气。进行如下研究:
(1)为减少燃煤对SO2的排放,可将煤转化为清洁燃料水煤气(CO和H2)。
已知:![]() ΔH=-241.8kJ·mol-1
ΔH=-241.8kJ·mol-1
![]() ΔH=-110.5kJmol-1
ΔH=-110.5kJmol-1
写出焦炭与1mol水蒸气反应生成水煤气的热化学方程式:________。
(2)①在101 kPa时,H2(g)在 1.00 mol O2(g)中完全燃烧生成2.00 mol H2O(l)放出571.6 kJ的热量,表示H2燃烧热的热化学方程式为________________________________。
②1.00 L 1.00 mol·L1 H2SO4溶液与2.00 L 1.00 mol·L1 NaOH溶液完全反应,放出114.6 kJ热量,表示其中和热的热化学方程式为____________________________。
(3)利用如图所示装置(电极均为惰性电极)可吸收SO2,并利用阴极排出的溶液吸收NO2。
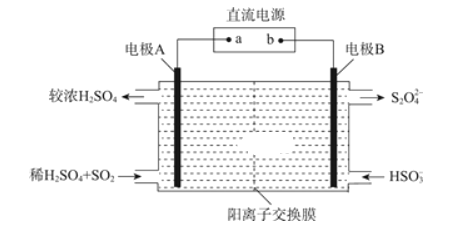
电极A的电极反应式为________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是化工生产的主要原料之一,氨气的用途非常广泛。在一固定容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,发生如下反应: N2(g)+3H2(g)![]() 2NH3(g)△H=-Q kJ/mol(Q>0)。
2NH3(g)△H=-Q kJ/mol(Q>0)。
(1)该反应所用的催化剂是_______(填写名称);该反应450℃时的平衡常数______500℃时的平衡常数(填“>”、“<”或“=”)。
(2)下列描述中能说明上述反应已达平衡的是_______
A. 3v正(H2)=2v逆(NH3) B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化 D.容器中气体的分子总数不随时间而变化
(3)上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2 mol计算从反应开始到平衡时,平均反应速率v(N2)为______________。
(4)在另一容积可变的容器内加入0.2 mol的N2和0.6 mol的H2,在相同条件下发生上述反应,则产生的NH3的物质的量比原平衡产生的NH3______(填“多”或“少”或”“一样”)。
(5)工厂生产的氨水稀释后可作肥料。稀释氨水时,随着水的增加溶液中减少的是_______
a.  b.
b. 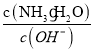 c.
c. 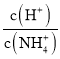 d.
d. 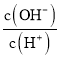
(6)液氨和水类似,也能电离:2NH3![]() NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K____2×10-30(填“<”、“>”或“=”);
NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K____2×10-30(填“<”、“>”或“=”);
②将少量金属钠投入液氨中,完全反应后所得溶液中各微粒的浓度大小关系为:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示是一套蒸馏装置,图中的错误是__________________。
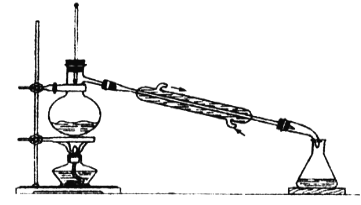
(2)若用蒸馏的方法分离甘油(沸点290℃)和水的混合物,被蒸馏出来的物质是___________,从温度计上判断该物质已被完全蒸出的现象是______________。
(3)若用蒸馏的方法分离出![]() (沸点为76.8℃)中含有的乙醚
(沸点为76.8℃)中含有的乙醚![]() (沸点为45℃),应控制温度在______________。
(沸点为45℃),应控制温度在______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个石墨作电极,电解稀的Na2SO4溶液的装置,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液。下列有关叙述正确的是
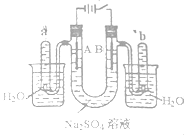
A.逸出气体的体积,A电极的小于B电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.A电极附近呈红色,B电极附近呈蓝色
D.电解一段时间后,将全部电解液转移到同一烧杯中,充分搅拌后溶解呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知蓄电池在充电时作电解池,放电时作原电池.如图是铅蓄电池的工作示意图,其反应原理为:PbO2+Pb+2H2SO4![]() 2PbSO4+2H2O下列说法中错误的是( )
2PbSO4+2H2O下列说法中错误的是( )

A.b电极放电后转化为c电极
B.电极a和d都发生还原反应
C.b的电极反应式:Pb+SO42﹣﹣2e-→PbSO4
D.放电后硫酸溶液的pH增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com