
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量 FeS2)为原料,生产氧化铝并获得 Fe3O4的部分工艺流程如图,下列叙述错误的是( )
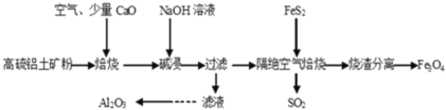
A.烧渣分离可以选择用磁铁将烧渣中的 Fe3O4 分离出来
B.隔绝空气焙烧时理论上反应消耗的 n(FeS2)∶n(Fe2O3)=1∶6
C.向滤液中通入过量CO2、过滤、洗涤、灼烧沉淀可制得 Al2O3
D.加入 CaO 可以减少 SO2 的排放同时生成建筑材料 CaSO4
【答案】B
【解析】
由流程可知,高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,通入空气焙烧时,因为含有少量FeS2,会产生SO2,加入氧化钙达到吸收SO2的目的,防止SO2排放污染空气,焙烧产物经过NaOH溶液碱浸,Al2O3与氢氧化钠反应生成偏铝酸钠,过滤后,滤液中通入过量CO2,偏铝酸根与CO2、水反应生成氢氧化铝沉淀,洗涤后灼烧氢氧化铝即可生产Al2O3;碱浸过程中,Fe2O3不与NaOH反应,过滤后留在滤渣中,加入FeS2与Fe2O3在隔绝空气的条件下反应生成SO2和Fe3O4,利用Fe3O4的磁性实现其与烧渣的分离,以此来解答。
A.Fe3O4有磁性,可以用磁铁将Fe3O4从烧渣中分离出来,故A正确;
B.隔绝空气焙烧,FeS2与Fe2O3反应,生成SO2和Fe3O4,反应方程式为FeS2+16Fe2O3![]() 11Fe3O4+2SO2↑,由方程式可知n(FeS2):n(Fe2O3)=1:16,故B错误;
11Fe3O4+2SO2↑,由方程式可知n(FeS2):n(Fe2O3)=1:16,故B错误;
C.滤液中含有AlO2,通入过量CO2,发生反应:AlO2+CO2+2H2O=Al(OH)3↓+HCO3,生成Al(OH)3沉淀,经过过滤、洗涤后得到Al(OH)3,再灼烧Al(OH)3,反应为:2 Al(OH)3![]() Al2O3+3H2O,即可制得Al2O3,故C正确;
Al2O3+3H2O,即可制得Al2O3,故C正确;
D.铝土矿中含有FeS2,FeS2焙烧生成SO2,CaO与SO2、O2发生反应:2CaO+2SO2+O2=2CaSO4,CaSO4可用于建筑材料,故D正确;
故答案选B。


科目:高中化学 来源: 题型:
【题目】某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为2mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法正确的是( )
A.该溶液中所含的离子是:Fe2+、Al3+、SO42-、NO3-
B.若向该溶液中加入过量的稀硫酸,产生的气体分子数为1/3NA
C.若向该溶液中加入过量的稀硫酸后若再滴加FeCl2溶液,没有现象
D.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为160g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 kJ·mol-1,
②H2(g)+![]() O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1,下列有关说法正确的是( )
O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1,下列有关说法正确的是( )
A. 向含0.1molNaOH的溶液中加入一定体积的0.1mol·L-1乙二酸,反应中的能量变化如图所示
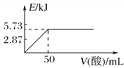
B. H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1
C. 氢气的标准燃烧热为241.8 kJ·mol-1
D. 若反应②中水为液态,则同样条件下的反应热:ΔH>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子的立体构型可用sp2杂化轨道来解释的是
①BF3 ②CH2═CH2 ③苯 ④CH≡CH ⑤NH3 ⑥CH4 ⑦HCHO.
A. ①②③⑦ B. ①②③⑤ C. ②③④⑦ D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是( )
A. 2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA
B. 100g9.8%的硫酸与磷酸的混合液中含有氧原子数为0.4NA
C. 惰性电极电解食盐水,若线路中通过1NA电子电量,则阳极产生气体11.2L
D. 0.1 mol的CaC2中含阴离子数是0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:Mg5Al3(OH)19(H2O)4![]() H2O↑+MgO+A12O3
H2O↑+MgO+A12O3
(1)请配平方程式_______________________。
(2)写出该化合物作阻燃剂的两条依据______。
(3)已知MgO可溶于NH4Cl的水溶液,其原理为______(用化学方程式和必要的文字说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的五种盐A、B、C、D、E,它们的阳离子可能是![]() 、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-。已知:
、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-。已知:
①五种盐均溶于水,水溶液均为无色;
②D的焰色反应呈黄色;③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性;
④若在这五种盐溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀;
⑤若在这五种盐溶液中分别加入氨水,E和C溶液中生成沉淀,继续加氨水,C中沉淀消失;
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀.
(1)五种盐中所含阴离子相同的两种盐的化学式是______。
(2)D溶液显碱性的原因是______(用离子方程式表示)。
(3)A和C的溶液反应的离子方程式是______,E和氨水反应的离子方程式是______。
(4)若要检验B中所含的阳离子,正确的实验方法是______。
(5)以石墨作电极,电解足量C的溶液,阳极的电极反应式为______,当转移0.2mol电子时,共产生气体______L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出14种元素的电负性。
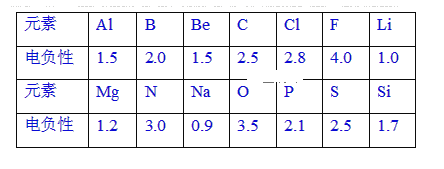
(1)根据表中给出的数据,可推知元素的电负性具有的变化规律是____。
(2)第3周期基态原子有2个未成对电子且电负性最大的元素是____(用元素符号表示)。
(3)下列化合物中属于共价化合物的是____。(Mg3N2、BeCl2、AlCl3、SiC)
(4)根据元素的电负性判断NCl3分子中Cl的化合价为____,已知水解反应前后各元素的化合价不变,则NCl3分子水解的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+2Y(g)![]() 3Z(g) H=﹣a kJ·molˉ1(a>0)。下列说法不正确的是( )
3Z(g) H=﹣a kJ·molˉ1(a>0)。下列说法不正确的是( )
A. 0.1 mol X和0.2 mol Y充分反应生成Z,放出能量一定小于0.1 a kJ
B. Y的起始浓度不能为零,平衡浓度也不能为零
C. 在其他条件不变的情况下,降低反应温度,正、逆反应速率均减小,平衡会发生移动
D. 当反应达到平衡状态时,一定存在3v(Y)正=2v(Z)逆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com