
【题目】常见的五种盐A、B、C、D、E,它们的阳离子可能是![]() 、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-。已知:
、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-。已知:
①五种盐均溶于水,水溶液均为无色;
②D的焰色反应呈黄色;③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性;
④若在这五种盐溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀;
⑤若在这五种盐溶液中分别加入氨水,E和C溶液中生成沉淀,继续加氨水,C中沉淀消失;
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀.
(1)五种盐中所含阴离子相同的两种盐的化学式是______。
(2)D溶液显碱性的原因是______(用离子方程式表示)。
(3)A和C的溶液反应的离子方程式是______,E和氨水反应的离子方程式是______。
(4)若要检验B中所含的阳离子,正确的实验方法是______。
(5)以石墨作电极,电解足量C的溶液,阳极的电极反应式为______,当转移0.2mol电子时,共产生气体______L(标准状况)。
【答案】(NH4)2SO4、Al2(SO4)3 CO32-+H2O![]() HCO3-+OH- Ag++Cl-=AgCl↓ Al3++3NH3H2O=Al(OH)3↓+3NH4+ 加NaOH加热,如能产生能使湿润的红色石蕊试纸变蓝的气体,证明有NH4+ 4OH--4e-=O2↑+2H2O 1.12
HCO3-+OH- Ag++Cl-=AgCl↓ Al3++3NH3H2O=Al(OH)3↓+3NH4+ 加NaOH加热,如能产生能使湿润的红色石蕊试纸变蓝的气体,证明有NH4+ 4OH--4e-=O2↑+2H2O 1.12
【解析】
①五种盐均溶于水,水溶液均为无色,则没有Cu2+、Fe3+;
②D的焰色反应呈黄色,则D中有Na+;
③A的溶液呈中性,B、C、E的溶液呈酸性则含有NH4+、Al3+、Ag+,D的溶液呈碱性,则D中含有CO32-,根据阳离子可知D为Na2CO3;
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀,则A、C中没有SO42-;
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失,说明C中为Ag+,则E中有Al3+;所以C为AgNO3;
⑥把A溶液呈中性分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀,则A为BaCl2;由以上分析可知E中含有Al3+,B中含有NH4+,加BaCl2均能生成不溶于稀硝酸的沉淀,则B、E中含有SO42-;所以B、E为(NH4)2SO4、Al2(SO4)3,以此解答该题。
根据上述分析可知A为BaCl2;B为(NH4)2SO4;C为AgNO3;D为Na2CO3;E为Al2(SO4)3。
(1)由以上分析可知所含阴离子相同的两种盐的化学式是(NH4)2SO4、Al2(SO4)3;
(2)D的化学式为Na2CO3;Na2CO3是强碱弱酸盐,在溶液中CO32-发生水解作用,消耗水电离产生的H+,促进了水的电离,最终达到平衡时,溶液中c(OH-)>c(H+),溶液显碱性,用离子方程式表示为:CO32-+H2O![]() HCO3-+OH-;
HCO3-+OH-;
(3)A和C的溶液反应的离子方程式为Ag++Cl-=AgCl↓,Al2(SO4)3和氨水反应的离子方程式是Al3++3NH3H2O=Al(OH)3↓+3NH4+;
(4)检验(NH4)2SO4中所含的阳离子NH4+的方法为:取少量(NH4)2SO4于试管中,滴加少量NaOH溶液,在试管口附近放一张湿润的红色石蕊试纸,加热,若试纸变蓝,说明B中阳离子为NH4+;
(5)C中为AgNO3,电解时阳极上OH-失去电子,发生氧化反应,阳极的电极反应式为4OH--4e-=O2↑+2H2O,当转移0.2mol电子时,可生成0.05mol氧气,其在标准状况下的体积V(O2)=0.05mol×22.4L/mol=1.12L。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
【题目】三氯化碘(IC13)在药物合成中用途非常广泛。已知ICl3熔点33℃,沸点73℃,有吸湿性,遇水易水解。某小组同学用下列装置制取ICl3(部分夹持和加热装置省略)。
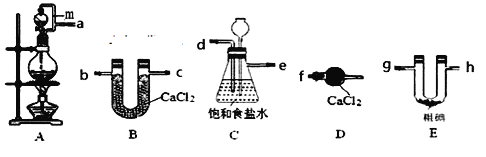
(1)装置A中发生反应的化学方程式为_________________________。
(2)按照气流方向连接接口顺序为a→_________________。装置A中导管m的作用是________。
(3)装置C用于除杂,同时作为安全瓶,能监测实验进行时后续装置是否发生堵塞,若发生堵塞C中的现象为____________________。
(4)氯气与单质碘需在温度稍低于70℃下反应,则装置E适宜的加热方式为________。装置E中发生反应的化学方程式为__________________。
(5)该装置存在的明显缺陷是_________。
(6)粗碘的制备流程为:
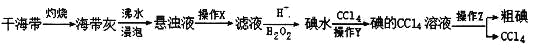
操作Y用到的玻璃仪器有烧杯、____________,操作Z的名称为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白色固体混合物A,含有KCl、CaCO3、Na2CO3、Na2SiO3、CuSO4中的几种,常温常压下进行如下实验。
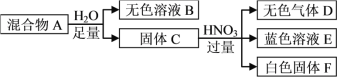
下列推断不正确的是
A. 无色溶液B的pH≥7
B. 白色固体F的主要成分是H2SiO3
C. 混合物A中有Na2SiO3、CuSO4和CaCO3
D. 在无色溶液B中加HNO3酸化,无沉淀;再滴加AgNO3,若有白色沉淀生成,说明混合物A中有KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量 FeS2)为原料,生产氧化铝并获得 Fe3O4的部分工艺流程如图,下列叙述错误的是( )
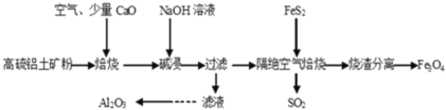
A.烧渣分离可以选择用磁铁将烧渣中的 Fe3O4 分离出来
B.隔绝空气焙烧时理论上反应消耗的 n(FeS2)∶n(Fe2O3)=1∶6
C.向滤液中通入过量CO2、过滤、洗涤、灼烧沉淀可制得 Al2O3
D.加入 CaO 可以减少 SO2 的排放同时生成建筑材料 CaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列模型并结合有关信息,判断下列说法不正确的是( )
晶体硼(其每个结构单元中有12个B原子) | NaCl | S8 | HCN | |
结构模型示意图 |
|
|
|
|
备注 | 熔点2573K | —— | 易溶于CS2 | —— |
A.晶体硼属于原子晶体,结构单元中含有30个B-B键,含20个正三角形
B.NaCl晶体中每个Na+周围距离最近且相等的Na+有6个
C.S8分子中的共价键为非极性键
D.HCN分子中含有2个σ键,2个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X常温下为气体, a、b、c 是中学化学常见物质, 均由常见元素组成, 转化关系(反应条件略去)如图所示, 下列说法不正确的是

A. 若 b 为固态非金属单质,b 与 X 所含元素同主族,则c也能与 X 反应
B. 若 X 为 O2,a 为一种固态单质,则c可能为CO2或 SO3
C. 若 a、b、c 焰色反应均呈黄色,水溶液均呈碱性,则a中可能既含有离子键又含有共价键
D. 若 b 为气态非金属单质,b 与 X 所含元素同周期,则 X 与 b 所含元素原子的核电荷数相差1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4 是一种重要化工原料,其制备和有关性质如图所示。
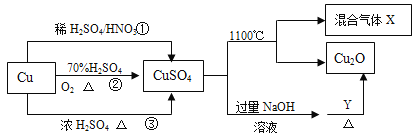
(1)现要用密度为 1.84g/mL,质量分数为 98%的浓硫酸来配制步骤①中所需要的 2mol/L 的稀硫酸480mL,需要用这种浓硫酸的体积为_____mL。
(2)配制该稀硫酸所用到的玻璃仪器除玻璃棒、量筒外还有_____。
(3)下列操作会使所配溶液浓度偏高的是_____。
A. 硫酸转移至容量瓶后,没有洗涤烧杯
B. 未冷却至室温就转移至容量瓶
C. 容量瓶中存在少量蒸馏水
D. 定容时俯视刻度
E. 用量筒量取浓硫酸后洗涤量筒
(4)制取硫酸铜的途径①②③中,不用_____途径,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I3-(aq)。测得不同温度下该反应的平衡常数K如表所示:
t/℃ | 5 | 15 | 25 | 35 | 50 |
K | 1 100 | 841 | 689 | 533 | 409 |
下列说法正确的是 ( )。
A.反应I2(aq)+I-(aq)![]() I3-(aq)的ΔH>0
I3-(aq)的ΔH>0
B.其他条件不变,升高温度,溶液中c(I3-)减小
C.该反应的平衡常数表达式为K=![]()
D.25 ℃时,向溶液中加入少量KI固体,平衡常数K小于689
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中各种化学键如图所示,关于乙醇在各种反应中断裂键的说法错误的是( )
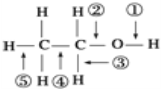
A.乙醇和浓硫酸共热到140℃时断键①或者②
B.乙醇在Ag催化下和O2反应断键①和③
C.乙醇和浓硫酸共热到170℃时断键②和③
D.乙醇和乙酸在浓硫酸存在的条件下共热时断键①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com