
【题目】CuSO4 是一种重要化工原料,其制备和有关性质如图所示。
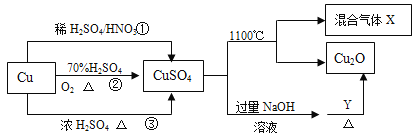
(1)现要用密度为 1.84g/mL,质量分数为 98%的浓硫酸来配制步骤①中所需要的 2mol/L 的稀硫酸480mL,需要用这种浓硫酸的体积为_____mL。
(2)配制该稀硫酸所用到的玻璃仪器除玻璃棒、量筒外还有_____。
(3)下列操作会使所配溶液浓度偏高的是_____。
A. 硫酸转移至容量瓶后,没有洗涤烧杯
B. 未冷却至室温就转移至容量瓶
C. 容量瓶中存在少量蒸馏水
D. 定容时俯视刻度
E. 用量筒量取浓硫酸后洗涤量筒
(4)制取硫酸铜的途径①②③中,不用_____途径,原因是_____。
【答案】54.3 烧杯 、500mL容量瓶、 胶头滴管 BDE ①③ 浪费原料,污染环境
【解析】
(1)依据c=![]() 计算浓硫酸的物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸的体积;
计算浓硫酸的物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸的体积;
(2)依据配制一定物质的量浓度溶液的一般步骤选择需要的仪器;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据c=![]() 进行误差分析;
进行误差分析;
(4)从反应成本和对环境的影响角度进行分析。
(1)密度为1.84g/mL,质量分数为98%的浓硫酸物质的量浓度为:![]() mol/L=18.4mol/L,配制480mL0.1mol/L的稀硫酸,应选择500mL容量瓶,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:18.4mol/L×V=2mol/L×500mL,解得V=54.3mL;
mol/L=18.4mol/L,配制480mL0.1mol/L的稀硫酸,应选择500mL容量瓶,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:18.4mol/L×V=2mol/L×500mL,解得V=54.3mL;
(2)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器为:量筒、烧杯、玻璃棒、500 mL容量瓶和胶头滴管,故还需要用到的玻璃仪器是烧杯、500mL容量瓶、胶头滴管;
(3)A.硫酸转移至容量瓶后,没有洗涤烧杯,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故A不符合题意;
B.未冷却至室温就转移至容量瓶,导致定容时加水体积偏小,溶液体积偏小,溶液浓度偏高,故B符合题意;
C.容量瓶中存在少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故C不符合题意;
D.定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故D符合题意;
E.量筒是量出式仪器,不需要洗涤,用量筒量取浓硫酸后洗涤量筒,导致量取浓硫酸体积偏大,硫酸的物质的量偏大,溶液浓度偏高,故E符合题意;答案选BDE;
(4)途径①是Cu与稀硫酸和硝酸反应生成CuSO4,同时生成NO气体污染环境;途径③是Cu与浓硫酸加热反应生成CuSO4,同时生成SO2气体污染环境;途径②Cu先与O2反应生成CuO,CuO与稀硫酸反应生成CuSO4,原料利用率高,且不污染环境;故不用①③途径,原因是浪费原料,污染环境。


科目:高中化学 来源: 题型:
【题目】我国拥有自主知识产权的硅衬底高光效氮化镓发光二极管(简称LED)技术,已广泛用于照明,显像等多个领域。氮化镓的原子结构示意图及镓在元素周期表中的信息如图所示,下列说法不正确的是( )

A.氮元素位于元素周期表的第二周期
B.镓原子与镓离子相对原子质量几乎相等
C.镓的相对原子质量为69.72
D.一个Ga3+有34个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是( )
A. 2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA
B. 100g9.8%的硫酸与磷酸的混合液中含有氧原子数为0.4NA
C. 惰性电极电解食盐水,若线路中通过1NA电子电量,则阳极产生气体11.2L
D. 0.1 mol的CaC2中含阴离子数是0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的五种盐A、B、C、D、E,它们的阳离子可能是![]() 、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-。已知:
、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-。已知:
①五种盐均溶于水,水溶液均为无色;
②D的焰色反应呈黄色;③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性;
④若在这五种盐溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀;
⑤若在这五种盐溶液中分别加入氨水,E和C溶液中生成沉淀,继续加氨水,C中沉淀消失;
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀.
(1)五种盐中所含阴离子相同的两种盐的化学式是______。
(2)D溶液显碱性的原因是______(用离子方程式表示)。
(3)A和C的溶液反应的离子方程式是______,E和氨水反应的离子方程式是______。
(4)若要检验B中所含的阳离子,正确的实验方法是______。
(5)以石墨作电极,电解足量C的溶液,阳极的电极反应式为______,当转移0.2mol电子时,共产生气体______L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2mol NaHCO3 和1mol Na2O2 混合,在密闭容器中充分混合加热后,最后排出气体,残留的固体是( )
A.Na2CO3B.Na2O2 和 Na2CO3
C.NaOH 和 Na2CO3D.Na2O2 和 Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出14种元素的电负性。
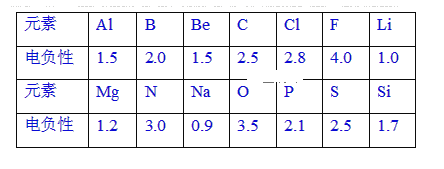
(1)根据表中给出的数据,可推知元素的电负性具有的变化规律是____。
(2)第3周期基态原子有2个未成对电子且电负性最大的元素是____(用元素符号表示)。
(3)下列化合物中属于共价化合物的是____。(Mg3N2、BeCl2、AlCl3、SiC)
(4)根据元素的电负性判断NCl3分子中Cl的化合价为____,已知水解反应前后各元素的化合价不变,则NCl3分子水解的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图:
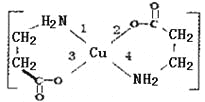
(1)基态Cu2+的最外层电子排布式为__。
(2)二甘氨酸合铜(II)中,第一电离能最大的元素与电负性最小的非金属元素可形成多种微粒,其中一种是5核10电子的微粒,该微粒的空间构型是__。
(3)lmol二甘氨酸合铜(II)含有的π键数目是__。
(4)二甘氨酸合铜(II)结构中,与铜形成的化学键中一定属于配位键的是__(填写编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中所含的少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的的是( )
选项 | 混合物 | 试剂 | 分离方法 |
A | 溴苯(溴) |
| 分液 |
B | 乙醇(水) |
| 过滤 |
C | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
D | 乙酸乙酯(乙酸) |
| 分液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电化学法制备LiOH的实验装置如图,采用惰性电极,a口导入LiCl溶液,b口导入LiOH溶液,下列叙述正确的是( )
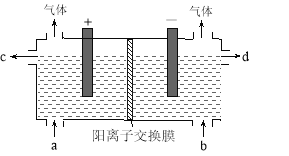
A.通电后阳极区溶液pH增大
B.阴极区的电极反应式为4OH-–4e-=O2↑+2H2O
C.当电路中通过1mol电子的电量时,会有0.25mol的Cl2生成
D.通电后Li+通过交换膜向阴极区迁移,LiOH浓溶液从d口导出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com