
【题目】在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I3-(aq)。测得不同温度下该反应的平衡常数K如表所示:
t/℃ | 5 | 15 | 25 | 35 | 50 |
K | 1 100 | 841 | 689 | 533 | 409 |
下列说法正确的是 ( )。
A.反应I2(aq)+I-(aq)![]() I3-(aq)的ΔH>0
I3-(aq)的ΔH>0
B.其他条件不变,升高温度,溶液中c(I3-)减小
C.该反应的平衡常数表达式为K=![]()
D.25 ℃时,向溶液中加入少量KI固体,平衡常数K小于689
科目:高中化学 来源: 题型:
【题目】已知:①H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 kJ·mol-1,
②H2(g)+![]() O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1,下列有关说法正确的是( )
O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1,下列有关说法正确的是( )
A. 向含0.1molNaOH的溶液中加入一定体积的0.1mol·L-1乙二酸,反应中的能量变化如图所示
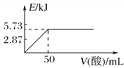
B. H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1
C. 氢气的标准燃烧热为241.8 kJ·mol-1
D. 若反应②中水为液态,则同样条件下的反应热:ΔH>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的五种盐A、B、C、D、E,它们的阳离子可能是![]() 、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-。已知:
、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-。已知:
①五种盐均溶于水,水溶液均为无色;
②D的焰色反应呈黄色;③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性;
④若在这五种盐溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀;
⑤若在这五种盐溶液中分别加入氨水,E和C溶液中生成沉淀,继续加氨水,C中沉淀消失;
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀.
(1)五种盐中所含阴离子相同的两种盐的化学式是______。
(2)D溶液显碱性的原因是______(用离子方程式表示)。
(3)A和C的溶液反应的离子方程式是______,E和氨水反应的离子方程式是______。
(4)若要检验B中所含的阳离子,正确的实验方法是______。
(5)以石墨作电极,电解足量C的溶液,阳极的电极反应式为______,当转移0.2mol电子时,共产生气体______L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出14种元素的电负性。
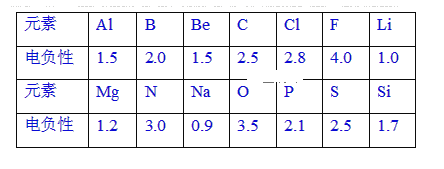
(1)根据表中给出的数据,可推知元素的电负性具有的变化规律是____。
(2)第3周期基态原子有2个未成对电子且电负性最大的元素是____(用元素符号表示)。
(3)下列化合物中属于共价化合物的是____。(Mg3N2、BeCl2、AlCl3、SiC)
(4)根据元素的电负性判断NCl3分子中Cl的化合价为____,已知水解反应前后各元素的化合价不变,则NCl3分子水解的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图:
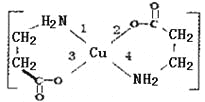
(1)基态Cu2+的最外层电子排布式为__。
(2)二甘氨酸合铜(II)中,第一电离能最大的元素与电负性最小的非金属元素可形成多种微粒,其中一种是5核10电子的微粒,该微粒的空间构型是__。
(3)lmol二甘氨酸合铜(II)含有的π键数目是__。
(4)二甘氨酸合铜(II)结构中,与铜形成的化学键中一定属于配位键的是__(填写编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,在CO2低压合成甲醇反应(CO2+3H2===CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为___nm。MnO也属于NaCl型结构,晶胞参数为a′=0.448 nm,则r(Mn2+)为_______nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中所含的少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的的是( )
选项 | 混合物 | 试剂 | 分离方法 |
A | 溴苯(溴) |
| 分液 |
B | 乙醇(水) |
| 过滤 |
C | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
D | 乙酸乙酯(乙酸) |
| 分液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+2Y(g)![]() 3Z(g) H=﹣a kJ·molˉ1(a>0)。下列说法不正确的是( )
3Z(g) H=﹣a kJ·molˉ1(a>0)。下列说法不正确的是( )
A. 0.1 mol X和0.2 mol Y充分反应生成Z,放出能量一定小于0.1 a kJ
B. Y的起始浓度不能为零,平衡浓度也不能为零
C. 在其他条件不变的情况下,降低反应温度,正、逆反应速率均减小,平衡会发生移动
D. 当反应达到平衡状态时,一定存在3v(Y)正=2v(Z)逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性:苯甲酸>碳酸>苯酚,现将![]() 转变为
转变为![]() 的方法为( )
的方法为( )
A.与稀H2SO4共热后,加入足量的Na2CO3
B.加入足量的NaOH溶液,再通入足量的HCl
C.与足量的NaOH溶液共热后,再通入CO2
D.与稀H2SO4共热后,加入足量的NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com