
| A、1:1 | B、1:2 |
| C、1:3 | D、2:1 |


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
| A、①③⑤ | B、①②④ |
| C、③④⑤ | D、①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
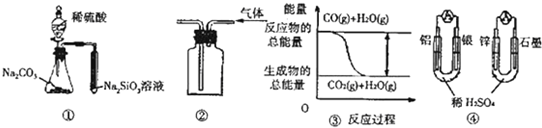
| A、用图 ①所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| B、用图 ②所示实验装置排空气法收集CO2气体 |
| C、图 ③表示CO(g)+H2O(g)?CO2(g)+H2(g)为吸热反应 |
| D、图 ④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y的最简单气态氢化物的水溶液呈酸性 |
| B、X的氢化物中一定含有极性共价键,也可能含有非极性共价键 |
| C、标准状况下,等质量Z的两个氧化物,其体积之比为5:4 |
| D、X与W形成的化合物中混有一定量的水,最好采用蒸馏方法分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
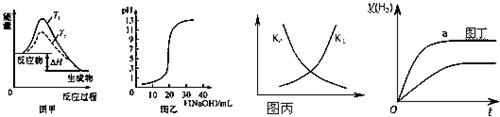
| A、图甲表示温度T1>T2,SO2与O2反应过程中的能量变化 |
| B、图乙表示0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L CH3COOH溶液所得到的滴定曲线 |
| C、图丙表示恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 |
| D、图丁表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
| 时间/min | CO2 | H2 | CO | H2O |
| 0 | 0.2000 | 0.3000 | 0 | 0 |
| 2 | 0.1740 | 0.2740 | 0.0260 | 0.0260 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | |
| 5 | 0.0727 | 0.1727 | 0.1273 | 0.1273 |
| 6 | 0.0350 | 0.1350 | 0.1650 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
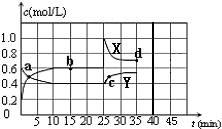 已知:2NO2(g)?N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.请回答:
已知:2NO2(g)?N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com