
【题目】下列方程式书写正确的是
A. HCO3-在水溶液中的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. H2SO4的电离方程式H2SO4![]() 2H++SO42-
2H++SO42-
C. CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. CaCO3的电离方程式:CaCO3![]() Ca2++CO32-
Ca2++CO32-
【答案】A
【解析】
强电解质在水溶液中是完全电离,电离方程式用“=”表示,弱电解质则是部分电离,电离方程式用“![]() ”表示,多元弱酸水解分步进行,据此分析作答。
”表示,多元弱酸水解分步进行,据此分析作答。
A. 碳酸氢根离子在溶液中电离出碳酸根离子和氢离子,可表示为:HCO3-+H2O![]() H3O++CO32-,或HCO3-
H3O++CO32-,或HCO3-![]() H++CO32-,故A项正确;
H++CO32-,故A项正确;
B. 硫酸为二元强酸,在水溶液中发生完全电离,其电离方程式为:H2SO4 = 2H++SO42-,故B项错误;
C. 碳酸根离子水解生成碳酸氢根离子和氢氧根离子,其水解过程分两步进行,以第一步为主,水解方程式为:CO32-+H2O![]() HCO3-+OH-,故C项错误;
HCO3-+OH-,故C项错误;
D. 碳酸钙为强电解质,其电离方程式为:CaCO3 = Ca2++CO32-,故D项错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】二氧化硅晶体是立体的网状结构,其结构如图所示。关于二氧化硅的下列说法中,不正确的是( )

A. 晶体中Si、O原子个数比为1∶2
B. 晶体中最小原子环上的原子数为8
C. 晶体中最小原子环上的原子数为12
D. 晶体中Si、O原子最外层都满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】湖南大学研制的一种铝离子电池充放电7500次后容量几乎没有衰减,预测20年后该电池依然使用如初。其放电时的有关转化如图所示。下列说法中正确的是( )

A. 放电时,Li+向负极移动
B. 放电时,电路中每流过3mol电子,正极的质量减少27g
C. 充电时,阴极的电极反应式为4Al2Cl7- +3e-=7AlCl4- +Al
D. 充电时,MnO2极与外电源的负极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制500mL0.1mol/LNa2CO3,溶液回答下列问题
(1)配制Na2CO3溶液时需用的主要仪器有托盘天平、滤纸、烧杯、药匙、量筒、___、___、___。
(2)配制溶液过程如下:
A.用托盘天平称取Na2CO3·10H2O晶体___g;
B.将固体置于烧杯中,用量筒向其中加水溶解,并恢复至室温;
C.用玻璃棒引流,将溶液转移至容量瓶;
D.洗涤玻璃棒和烧杯2-3次,将洗涤液都转移入容量瓶中;
E.___;
F.继续向容量瓶中注水,至液面离容量瓶颈刻度线下___cm时,改用___滴加蒸馏水至液面与刻度线相切;
G.盖好瓶塞,用食指抵住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次摇匀;
H.将溶液转移至试剂瓶中,贴上标签,标注试剂名称、浓度及配制时间。
(3)若实验遇下列情况,溶液的浓度是偏高,偏低还是不变?
A.加水时超过刻度线___;
B.溶解后未冷却到室温就转入容量瓶___;
C.容量瓶内壁附有水珠而未干燥处理___;
D.定容时仰视___;
E.上下颠倒摇匀后液面低于刻度线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 I.依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)设计的原电池如图所示。
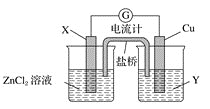
请回答下列问题:
(1)铜电极为电池的________极;电解质溶液Y是________________。
(2)盐桥中的Cl-向________(填“左”、或“右”)移动,如将盐桥撤掉,电流计的指针将不偏转。
Ⅱ.电解原理在化学工业中有广泛应用。
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请完成以下问题:
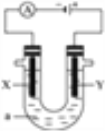
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液:
①在X极附近观察到的现象是_________________;
②电解一段时间后,该反应总离子方程式_______________________________;
(2)若用该装置电解精炼铜,电解液a选用CuSO4溶液,则:X电极的材料是____________电解一段时间后,CuSO4溶液浓度_________(填“增大”、减小”或“不变”)。
(3)若X、Y都是惰性电极,a是溶质为Cu(NO3)2和X(NO3)3,且均为0.1 mol的混合溶液,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图所示,则Cu2+、X3+、H+氧化能力由大到小的顺序是_____。
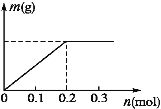
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,按下列物质的量关系进行反应,其对应的离子方程式或化学方程式书写正确的是
A.n(Cl2)∶n(Fe)=5∶4;5Cl2+4Fe![]() 2FeCl2+2FeCl3
2FeCl2+2FeCl3
B.n(Cl2)∶n(FeBr2)=1∶1;Fe2++2Br+Cl2=Fe3++Br2+2Cl
C.n(MnO4-)∶n(H2O2)=2∶3;2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O
D.n(Fe) ∶n[HNO3(稀)]=1∶3;4Fe+12H++3NO3-=3Fe2++Fe3++3NO↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
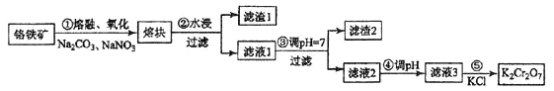
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。

a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与“物质的量”相关的计算正确的是( )
A.现有CO、CO2、O3三种气体,它们分别都含有1 mol O,则三种气体原子个数之比为3∶2∶1
B.28 g CO和22.4 L CO2中含有的碳原子数一定相等
C.标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32
D.a g Cl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量Cl2缓缓通入含0.02mol H2SO3和0.02mol HBr的混合溶液中。在此过程中溶液的pH与Cl2用量的关系示意图是(溶液体积变化忽略不计,且不考虑Cl2与水反应)
A. 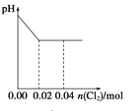 B.
B. 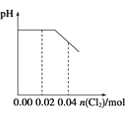 C.
C.  D.
D. 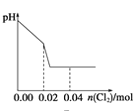
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com