
【题目】请按要求回答下列问题。
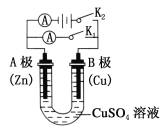
(1)①打开K2,合并K1。A电极可观察到的现象是_____________;B极的电极反应式为________________。
②打开K1,合并K2。A电极可观察到的现象是____________;B极的电极反应为________________________。
(2)判断原电池的正负极时,不仅要看金属活泼性顺序,还要注意此金属在电解质溶液中的活泼性。试回答下列问题:将铝片和铜片用导线连接,若插入浓硝酸中形成原电池,负极是 ,若插入氢氧化钠溶液中形成原电池,负极是 。
【答案】(1)①锌不断溶解;Cu2++2e-=Cu ②电极表面有红色固体附着;Cu-2e-=Cu2+
(2)铜片 铝片
【解析】
试题分析:(1)①打开K2,合并K1,此时构成原电池,锌的金属性强于铜,锌是负极,铜是正极,则A电极可观察到的现象是锌不断溶解;B极的电极反应式为Cu2++2e-=Cu。
②打开K1,合并K2,此时构成电解池,锌电极与电源的负极相连,是阴极,溶液中的铜离子放电,则A电极可观察到的现象是电极表面有红色固体附着;B极是阳极,铜失去递增,则B电极反应为Cu-2e-=Cu2+。
(2)将铝片和铜片用导线连接,若插入浓硝酸中形成原电池,由于常温下铝在浓硝酸中钝化,则负极是铜片;若插入氢氧化钠溶液中形成原电池,由于铝能与氢氧化钠溶液反应,则负极是铝片


科目:高中化学 来源: 题型:
【题目】最近《科学》杂志评出10大科技突破,其中“火星上‘找’到水的影子”名列第一。下列关于水的说法中正确的是
A水的电离过程是放热的过程
B水的电离和电解都需要电
C冰熔化成水是一个吸热的过程
D加入电解质一定会破坏水的电离平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,将224L的HCl气体溶于815mL水中 (ρ=1.00g/cm 3), 所得盐酸的密度是1.18g/cm 3。
(1)取该盐酸10.0mL,稀释至250.0mL,所得稀盐酸的物质的量浓度?
(2)若将原盐酸溶液与430mL密度为1.14g/cm3质量分数为20%的硫酸混合,(忽略混合时溶液体积变化),求混合后溶液中H+ 物质的量浓度?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚碳酸酯无色透明,具有优异的抗冲击性,能用于制造宇航员的面罩、智能手机机身外壳等。双酚化合物是合成聚碳酸酯的单体之一,某种双酚化合物G的合成路线如下:
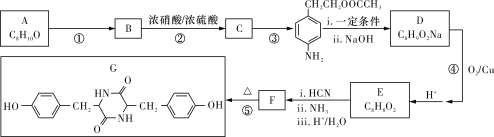
已知:![]()
NO2![]() NH2
NH2
(1)G中所含的官能团的名称是酰胺键和____________;B的核磁共振氢谱有________个峰。
(2)写出反应类型:反应① __________;反应③____________。
(3)写出A的名称 ______________;F的结构简式_____________________。
(4)写出反应④的化学方程式:_________________________。
(5)C有多种同分异构体,写出同时满足下列条件的同分异构体的结构简式________________________。
(Ⅰ)属于α-氨基酸,且苯环上有三个互为间位的取代基
(Ⅱ)与FeCl3溶液作用无显色现象
(Ⅲ)1 mol该同分异构体与足量NaOH溶液反应时消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 反应A + 3B=2C在三种不同的情况下的反应速率分别为:
①υ(A)=0.15mol/(L·s)
②υ(B)=0.6mol/(L·s)
③υ(C)=0.4mol/(L·s)
该反应进行的快慢顺序为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com