
【题目】运用化学反应原理研究合成氨反应有重要意义,请完成下列探究:
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g)![]() H2(g) + CO(g) △H=+131.3kJ/mol,△S=+133.7J/(mol·K),该反应在低温下_______(填“能”或“不能”)自发进行。
H2(g) + CO(g) △H=+131.3kJ/mol,△S=+133.7J/(mol·K),该反应在低温下_______(填“能”或“不能”)自发进行。
(2)已知在 400℃时,N2(g) + 3H2(g) ![]() 2NH3(g)的 K=0.5
2NH3(g)的 K=0.5
①在400℃时,2NH3(g)![]() N2(g) + 3H2(g)的 K'=_________(填数值)。
N2(g) + 3H2(g)的 K'=_________(填数值)。
②400℃时,在 0.5L 的反应容器中进行合成氨反应,一段时间后,测得 N2、H2、NH3 的物质的量分别为 2mol、1mol、2mol,则此时反应 v(N2)正_____________ v(N2)逆(填 “>”、“<”、“=”或“不能确定”)。
③已 知 H—H 键 键 能 为 436kJ/mol , N—H 键 键 能 为 391kJ/mol , N N 键 键 能 为945.6kJ/mol,则反应N2(g)+ 3H2(g)![]() 2NH3(g)的△H= ____________。若在恒温、恒压条件下,向平衡体系中通入氩气,则平衡_____________(填“向左”、 “向右”或“不”)移动;使用催化剂_____________(填“增大”、“减小”或“不改变”)反 应的△H。
2NH3(g)的△H= ____________。若在恒温、恒压条件下,向平衡体系中通入氩气,则平衡_____________(填“向左”、 “向右”或“不”)移动;使用催化剂_____________(填“增大”、“减小”或“不改变”)反 应的△H。
(3)在 25℃下,将 a mol/L 的氨水和 0.01mol/L 的盐酸等体积混合,反应平衡时溶液中的 c(NH4+)=c(Cl-),则溶液显__________(填“酸”、“碱”或“中”)性;用含 a 的代数式表示 NH3H2O 电离常数 Kb= ______________________________________。
【答案】不能 2 = ![]() 向左 不改变 中
向左 不改变 中 ![]()
【解析】
(1)![]() ,在低温时该值大于0,所以不能在低温下自发进行,答案为:不能;
,在低温时该值大于0,所以不能在低温下自发进行,答案为:不能;
(2)N2(g) + 3H2(g)![]() 2NH3(g)与2NH3(g)
2NH3(g)与2NH3(g)![]() N2(g) + 3H2(g)互为可逆反应,平衡常数互为倒数,K'=2;一段时间后,测得N2、H2、NH3 的物质的量浓度分别为4 mol/L,2mol/L,4mol/L,
N2(g) + 3H2(g)互为可逆反应,平衡常数互为倒数,K'=2;一段时间后,测得N2、H2、NH3 的物质的量浓度分别为4 mol/L,2mol/L,4mol/L,![]() ,所以该状态是平衡状态,正逆反应速率相等;根据键能大小直接计算反应焓变
,所以该状态是平衡状态,正逆反应速率相等;根据键能大小直接计算反应焓变![]() ;在恒温、恒压条件下,向平衡体系中通入氩气,体积增大,相当于压强减小,平衡向气体分子数增大的方向移动,向左移动;催化剂不改变反应的焓变;答案为:2;=;
;在恒温、恒压条件下,向平衡体系中通入氩气,体积增大,相当于压强减小,平衡向气体分子数增大的方向移动,向左移动;催化剂不改变反应的焓变;答案为:2;=;![]() ;向左;不改变;
;向左;不改变;
(3)根据电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-),已知c(NH4+)=c(Cl-),所以c(H+)=c(OH-),显中性;此溶液中,c(NH4+)=c(Cl-)=0.005 mol/L,c(H+)=c(OH-)=![]() ;
;![]() ;NH3H2O电离常数
;NH3H2O电离常数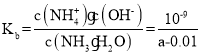 ;答案为:中;
;答案为:中;![]() 。
。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】任取两种烃混合,完全燃烧生成的CO2的物质的量小于H2O的物质的量,则这两种烃的组合不可能是 ( )
A.烷烃和烷烃B.烷烃和烯烃C.烷烃和炔烃D.烯烃和炔烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请写出下列有机化合物的结构简式和键线式。
(1) _______________、______________;
_______________、______________;
(2)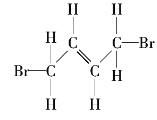 _______________、______________;
_______________、______________;
(3)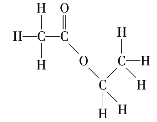 _______________、______________;
_______________、______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据环保要求,在处理有氰电镀废水时,剧毒的CN-离子在催化剂TiO2颗粒作用下,先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用如图装置进行实验,测定CN-被处理的百分率。

现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.2mol/L)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出相关主要反应的离子方程式:甲中的反应:____,乙中的反应:____。
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。丙装置中的试剂是____,丁装置的目的是_____;干燥管Ⅱ的作用是_____。
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比_____(填“偏高”或“偏低”),简述可能的原因:_____。
(4)若干燥管Ⅰ中碱石灰增重1.408g,则该实验中测得CN-被处理的百分率为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在1800K时,2Fe(s)+3/2O2(g)=Fe2O3(s) H= -354.2kJ/mol;
3Fe(s)+2O2(g)=Fe3O4(s) H= -550.9kJ/mol
则反应:2Fe3O4(s)+1/2O2(g) === 3Fe2O3(s)的H =_____ kJ·mol1,四氧化三铁在充满氧气的集气瓶中反应生成Fe2O3_____(填“能”或“不能”)自发进行。
(2)2018年是合成氨工业先驱哈伯(PHaber)获得诺贝尔奖100周年。N2和H2生成NH3的反应为:1/2N2(g)+3/2H2(g) ![]() NH3(g) △H(298K)= - 46.2KJmol-1,在Fe催化剂作用下的反应历程如下(*表示吸附态)
NH3(g) △H(298K)= - 46.2KJmol-1,在Fe催化剂作用下的反应历程如下(*表示吸附态)
化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+ H*![]() NH*;NH*+ H*
NH*;NH*+ H*![]() NH2*;NH2* + H*
NH2*;NH2* + H*![]() NH3*
NH3*
脱附:NH3*![]() NH3(g)
NH3(g)
其中, N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。 请回答:
①利于提高合成氨平衡产率的条件有__________。
A.低温 B.高温 C.低压 D.高压 E.催化剂
②实际生产中,常用Fe作催化剂,控制温度773K,压强3.0 ×105Pa,原料中N2和H2物质的量之比为1:2.8。
分析说明原料气中N2过量的两个理由_________;_____________。
③关于合成氨工艺的下列理解,正确的是_______。
A.合成氨反应在不同温度下的△H和△S都小于零
B.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
C.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S2Cl2是一种金黄色易挥发的液体,常用作橡胶硫化剂。某化学兴趣小组拟设计 实验制备少量的S2Cl2,査阅资料知:
①干燥的氯气在 110℃~140℃与硫反应,即可得到 S2Cl2。
②S 的熔点为 112.8℃、沸点为 444.6℃;S2Cl2 的熔点为-76℃、沸点为 138℃。
③S2Cl2+Cl2![]() 2SCl2。
2SCl2。
④S2Cl2 易和水发生歧化反应。

该小组设计的制备装置如如图(夹持仪器和加热装置已略去)
(1)连接好实验装置后的第一步实验操作是____________。
(2)A 装置中制取氯气的离子反应方程式_____________。
(3)装置 B、C 中的试剂分别是_____________,_____________; 若实验中缺少 C 装置,发现产品浑浊不清,请用化学方程式表示其原因____________。
(4)该实验的操作顺序应为_____________(用序号表示)。
①加热装置 A ②加热装置 D ③通冷凝水 ④停止加热装置 A ⑤停止加热装置 D
(5)图中 G 装置中应放置的试剂为______________,其作用为______________。
(6)在加热 D 时温度不宜过高,其原因是_______________; 为了提高 S2Cl2 的纯度,关键的操作是控制好温度和______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年11月《Nature Energy》报道了巾科院大连化学物理研究所科学家用Ni- BaH2 /Al2O3、Ni- LiH等作催化剂,实现了在常压、100-300℃的条件下合成氨。
(1)在元素周期表中,氧和与其相邻且同周期的两种元素的第一电离能由大到小的顺序为 __ ;基态Ni2+的核外电子排布式为 ___,若该离子核外电子空间运动状态有15种,则该离子处于 ___(填“基”或“激发”)态。
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中NO3的空间构型为____。
②甘氨酸中N原子的杂化类型为____,分子中σ键与π键的个数比为____,晶体类型是 ___,其熔点、沸点远高于相对分子质量几乎相等的丙酸(熔点为-2l℃,沸点为141℃)的主要原因:一是甘氨酸能形成内盐;二是____。
(3)NH3分子中的键角为107°,但在[Cu(NH3)4]2+离子中NH3分子的键角如图l所示,导致这种变化的原因是____

(4)亚氨基锂(Li2NH)是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图2所示,若晶胞参数为d pm,密度为ρg/cm3,则阿伏加德罗常数NA=____(列出表达式)mol-l。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
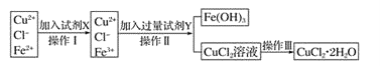
请参照下表给出的数据填空。

(1)操作I加入X的目的是___________________________ 。
(2)下列物质都可以作为X,适合本实验的X物质可以是_________(填字母)。
A KMnO4 B NaClO C H2O2 D Cl2
(3)操作II的Y试剂为____________(填化学式),并调节溶液的pH在______范围。
(4)实验室在配制CuCl2溶液时需加入少许_________(填物质名称),理由是(文字叙述并用有关离子方程式表示)__________________________________________。
(5)若将CuCl2溶液蒸干灼烧,得到的固体是_________________(填化学式);若要得无水CuCl2,请简述操作方法______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com