
【题目】任取两种烃混合,完全燃烧生成的CO2的物质的量小于H2O的物质的量,则这两种烃的组合不可能是 ( )
A.烷烃和烷烃B.烷烃和烯烃C.烷烃和炔烃D.烯烃和炔烃
【答案】D
【解析】
生成的CO2的物质的量小于生成的H2O的物质的量,则有机物组成中C、H原子数之比小于1:2;
A.烷烃的通式为:CnH2n+2,C、H原子数之比为:![]() ,比值一定小于1:2,故A可能;
,比值一定小于1:2,故A可能;
B.烯烃中C、H原子数之比为1:2,烷烃C、H原子数之比小于1:2,则烷烃和烯烃的混合物中,C、H原子数之比一定小于1:2,生成二氧化碳的物质的量一定小于生成水的物质的量,故B可能;
C.烷烃的通式为:CnH2n+2,C、H原子数之比小于1:2,炔烃的通式为:CnH2n-2,C、H原子数之比大于1:2,则烷烃和炔烃的混合物中,C、H原子数之比可能大于1:2,可能小于1:2,可能等于1:2,则生成二氧化碳的物质的量可能小于水的物质的量,故C可能;
D.烯烃的通式为:CnH2n,C、H原子数之比等于1:2,炔烃的通式为:CnH2n-2,则C、H原子数之比一定大于1:2,两种烃混合,完全燃烧后生成的CO2的物质的量一定大于生成的H2O的物质的量,故D不可能;
答案选D。


 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】工业上利用可逆反应N2(g)+3H2(g) ![]() 2NH3(g)合成氨,下列叙述正确的是( )
2NH3(g)合成氨,下列叙述正确的是( )
A.合成氨的适宜条件是高温高压催化剂,其中催化剂不改变该反应的逆反应速率
B.恒容通入氩气,使反应体系的压强增大,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,NH3 (g)的浓度分别是c1、c2,则时间间隔t1~t2内,NH3 (g)生成的平均速率为v=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:AgBr比AgCl更难溶,将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,发生的反应为
A. 只有AgBr沉淀生成 B. AgCl与AgBr沉淀等量生成
C. AgCl与AgBr沉淀都有,但以AgCl沉淀为主 D. AgCl与AgBr沉淀都有,但以AgBr沉淀为主
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习小组进行如下实验。
【探究反应速率的影响因素】设计了如下的方案并记录实验结果(忽略溶液混合体积变 化)。限选试剂和仪器:0.20mol/LH2C2O4 溶液、0.010mol/L KMnO4 溶液(酸性)、蒸馏水、 试管、量筒、秒表、恒温水浴槽
(1)上述实验①②是探究 对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则 a 为 ;乙是实验需要测量的物理量,则表 格中“乙”应填写 。
【测定 H2C2O4·xH2O 中 x 值】 已知:M(H2C2O4)=90g/mol
称取 1.260 g 纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液。
②取 25.00 mL 待测液放入锥形瓶中,再加入适的稀 H2SO4
③用浓度为 0.05000 mol·L-1 的 KMnO 标准溶液进行滴定;
(2)请写出与滴定有关反应的离子方程式
(3)某学生的滴定方式(夹持部分略去)如下,最合理的是 (选填 a、b)。


(4)由右图可知消耗 KMnO4 溶液体积为 mL;
(5)滴定过程中眼睛应注视_________________;
(6)通过上述数据,求得 x= 。以标准 KMnO4 溶液滴定样品溶液的浓度,未用 标准 KMnO4 溶液润洗滴定管,引起实验结果 (偏大、偏小或没有影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种瓦斯分析仪(如图甲)能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。
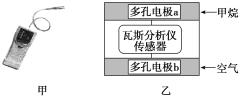
下列有关叙述正确的是( )
A.瓦斯分析仪工作时,电池外电路中电流由电极b流向电极a
B.电极b是正极,O2-由电极a流向电极b
C.电极a的反应式为CH4+5O2--8e-=CO32—+2H2O
D.当固体电解质中有1 mol O2-通过时,电子转移4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为研究过氧化钠与SO2的反应情况,进行如下探究。
(1)[提出假设]
向一定量的过氧化钠固体中通入足量的SO2,对反应后的固体产物成分及反应原理提出如下假设:
假设一:反应后固体中只有Na2SO3,证明SO2未被氧化;
假设二:反应后固体中只有Na2SO4,证明SO2完全被氧化;
假设三:反应后固体______,证明SO2部分被氧化。
(2)[定性研究]
为验证假设三,该小组进行如下研究,请你完成下表中内容。
实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
取适量反应后的固体放入试管中,____ | ______ |
(3)[定量研究]
通过测量气体的体积判断发生的化学反应,实验装置如图:
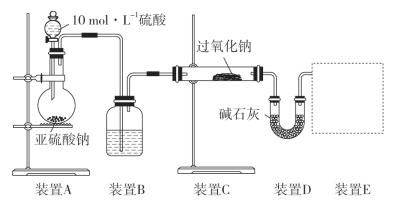
①装置B中所盛装试剂的名称为________。
②装置D的作用是__________。
③请画出实验装置E_____。
④实验测得装置C中过氧化钠质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),用上述有关测量数据进行填表判断。
SO2被氧化的程度 | V与m1或m2的关系 |
未被氧化 | |
完全被氧化 | V=0 |
部分被氧化 | _____ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异丁烯在催化剂存在下能发生加聚反应。
(1)写出异丁烯聚合成的高分子化合物的结构简式:________。
(2)在一定条件下,二分子异丁烯之间也能发生加聚反应,生成两种二聚物A和B。A和B在催化剂作用下加氢后都能得到2,2,4—三甲基戊烷C。试写出A、B、C的结构简式:____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备。
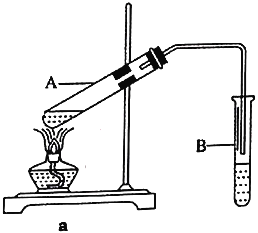
完成下列填空:
(1)实验中用到的三种试剂添加的先后顺序是____________________________。
(2)a装置中试管B中试剂的作用是________________________________________。
(3)实验时,通常加入过量的乙醇,原因是________________________________________。
(4)加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是_______________________;浓硫酸用量又不能过多,原因是______________________________________________。
(5)反应结束后,将B试管中收集到的产品倒入分液漏斗中,______________、_____________,然后分液。
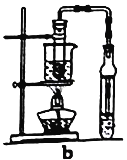
(6)若用b装置制备乙酸乙酯,其优点有____________、_____________。由b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是________________,分离乙酸乙酯与该杂质的方法是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究合成氨反应有重要意义,请完成下列探究:
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g)![]() H2(g) + CO(g) △H=+131.3kJ/mol,△S=+133.7J/(mol·K),该反应在低温下_______(填“能”或“不能”)自发进行。
H2(g) + CO(g) △H=+131.3kJ/mol,△S=+133.7J/(mol·K),该反应在低温下_______(填“能”或“不能”)自发进行。
(2)已知在 400℃时,N2(g) + 3H2(g) ![]() 2NH3(g)的 K=0.5
2NH3(g)的 K=0.5
①在400℃时,2NH3(g)![]() N2(g) + 3H2(g)的 K'=_________(填数值)。
N2(g) + 3H2(g)的 K'=_________(填数值)。
②400℃时,在 0.5L 的反应容器中进行合成氨反应,一段时间后,测得 N2、H2、NH3 的物质的量分别为 2mol、1mol、2mol,则此时反应 v(N2)正_____________ v(N2)逆(填 “>”、“<”、“=”或“不能确定”)。
③已 知 H—H 键 键 能 为 436kJ/mol , N—H 键 键 能 为 391kJ/mol , N N 键 键 能 为945.6kJ/mol,则反应N2(g)+ 3H2(g)![]() 2NH3(g)的△H= ____________。若在恒温、恒压条件下,向平衡体系中通入氩气,则平衡_____________(填“向左”、 “向右”或“不”)移动;使用催化剂_____________(填“增大”、“减小”或“不改变”)反 应的△H。
2NH3(g)的△H= ____________。若在恒温、恒压条件下,向平衡体系中通入氩气,则平衡_____________(填“向左”、 “向右”或“不”)移动;使用催化剂_____________(填“增大”、“减小”或“不改变”)反 应的△H。
(3)在 25℃下,将 a mol/L 的氨水和 0.01mol/L 的盐酸等体积混合,反应平衡时溶液中的 c(NH4+)=c(Cl-),则溶液显__________(填“酸”、“碱”或“中”)性;用含 a 的代数式表示 NH3H2O 电离常数 Kb= ______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com