
【题目】根据环保要求,在处理有氰电镀废水时,剧毒的CN-离子在催化剂TiO2颗粒作用下,先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用如图装置进行实验,测定CN-被处理的百分率。

现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.2mol/L)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出相关主要反应的离子方程式:甲中的反应:____,乙中的反应:____。
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。丙装置中的试剂是____,丁装置的目的是_____;干燥管Ⅱ的作用是_____。
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比_____(填“偏高”或“偏低”),简述可能的原因:_____。
(4)若干燥管Ⅰ中碱石灰增重1.408g,则该实验中测得CN-被处理的百分率为____。
【答案】CN-+ClO-![]() CNO-+Cl- 2CNO-+6ClO-+8H+=N2↑+2CO2↑+3Cl2↑+4H2O 浓硫酸 除去Cl2 防止空气中的CO2、水蒸气进入干燥管I,影响CO2的测量 偏低 前面装置中残留有CO2未被完全吸收 80%
CNO-+Cl- 2CNO-+6ClO-+8H+=N2↑+2CO2↑+3Cl2↑+4H2O 浓硫酸 除去Cl2 防止空气中的CO2、水蒸气进入干燥管I,影响CO2的测量 偏低 前面装置中残留有CO2未被完全吸收 80%
【解析】
含CN-废水放入甲中,在催化剂TiO2颗粒作用下,先用NaClO将CN-离子氧化成CNO-,则自身被还原为Cl-;反应后的溶液进入乙中,在稀硫酸的作用下,NaClO反应生成N2、CO2和Cl2;此时进入丙中的气体为N2、CO2和Cl2,因为干燥管I用于吸收CO2,而N2不能被碱石灰吸收,对CO2含量的测定不产生影响,所以在气体进入干燥管I之前,应将Cl2和水蒸气除尽,铜能与Cl2反应生成FeCl3,所以丙的作用是干燥气体。另外,干燥管Ⅱ的作用是确保干燥管I只吸收CO2,不吸收来自空气中的气体。
(1)根据题意,甲中,NaClO将CN-离子氧化成CNO-,则自身被还原为Cl-,反应的离子方程式为:CN-+ClO-![]() CNO-+Cl-;乙中,NaClO将CNO-转化为N2、CO2和Cl2,反应的离子方程式为:2CNO-+6ClO-+8H+=N2↑+2CO2↑+3Cl2↑+4H2O。答案为:CN-+ClO-
CNO-+Cl-;乙中,NaClO将CNO-转化为N2、CO2和Cl2,反应的离子方程式为:2CNO-+6ClO-+8H+=N2↑+2CO2↑+3Cl2↑+4H2O。答案为:CN-+ClO-![]() CNO-+Cl-;2CNO-+6ClO-+8H+=N2↑+2CO2↑+3Cl2↑+4H2O;
CNO-+Cl-;2CNO-+6ClO-+8H+=N2↑+2CO2↑+3Cl2↑+4H2O;
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。丙装置中的作用是干燥气体,所加试剂是浓硫酸;据以上分析,丁装置的目的是除去Cl2;干燥管Ⅱ的作用是防止空气中的CO2、水蒸气进入干燥管I,影响CO2的测量。答案为:浓硫酸;除去Cl2;防止空气中的CO2、水蒸气进入干燥管I,影响CO2的测量;
(3)假定上述每一个装置都充分吸收,但装置内残留的气体没有被赶出,被干燥剂I吸收的量偏少,则利用该装置测得的CN-被处理的百分率与实际值相比偏低,简述可能的原因:前面装置中残留有CO2未被完全吸收。答案为:偏低;前面装置中残留有CO2未被完全吸收;
(4)若干燥管Ⅰ中碱石灰增重1.408g,则被吸收的CO2的质量为1.408g,该实验中测得CN-的物质的量为:0.200mL×0.2mol/L=0.04mol,被处理的CN-的物质的量n(CN-)=n(CO2)=![]() =0.032mol,则被处理的CN-的百分率为
=0.032mol,则被处理的CN-的百分率为![]() =80%。答案为:80%。
=80%。答案为:80%。


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】化学学习小组进行如下实验。
【探究反应速率的影响因素】设计了如下的方案并记录实验结果(忽略溶液混合体积变 化)。限选试剂和仪器:0.20mol/LH2C2O4 溶液、0.010mol/L KMnO4 溶液(酸性)、蒸馏水、 试管、量筒、秒表、恒温水浴槽
(1)上述实验①②是探究 对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则 a 为 ;乙是实验需要测量的物理量,则表 格中“乙”应填写 。
【测定 H2C2O4·xH2O 中 x 值】 已知:M(H2C2O4)=90g/mol
称取 1.260 g 纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液。
②取 25.00 mL 待测液放入锥形瓶中,再加入适的稀 H2SO4
③用浓度为 0.05000 mol·L-1 的 KMnO 标准溶液进行滴定;
(2)请写出与滴定有关反应的离子方程式
(3)某学生的滴定方式(夹持部分略去)如下,最合理的是 (选填 a、b)。


(4)由右图可知消耗 KMnO4 溶液体积为 mL;
(5)滴定过程中眼睛应注视_________________;
(6)通过上述数据,求得 x= 。以标准 KMnO4 溶液滴定样品溶液的浓度,未用 标准 KMnO4 溶液润洗滴定管,引起实验结果 (偏大、偏小或没有影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
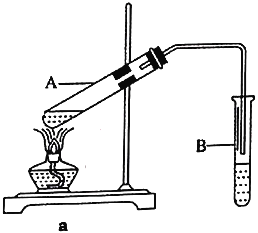
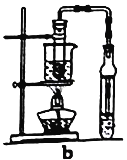
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备。
完成下列填空:
(1)实验中用到的三种试剂添加的先后顺序是____________________________。
(2)a装置中试管B中试剂的作用是________________________________________。
(3)实验时,通常加入过量的乙醇,原因是________________________________________。
(4)加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是_______________________;浓硫酸用量又不能过多,原因是______________________________________________。
(5)反应结束后,将B试管中收集到的产品倒入分液漏斗中,______________、_____________,然后分液。
(6)若用b装置制备乙酸乙酯,其优点有____________、_____________。由b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是________________,分离乙酸乙酯与该杂质的方法是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种中学化学中常见的单质及其化合物相互转化的关系图如下:
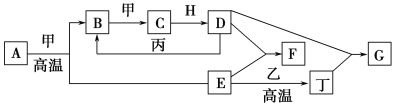
可供参考的信息有:
①甲、乙、丙、丁为单质,其余为化合物。A、E、F、G四种物质中含同种元素。
②A由X和Y两种元素组成,其原子个数比为1∶2,元素质量之比为7∶8。
③B气体是引起酸雨的主要物质,H常温下为无色无味的液体,E常用作红色油漆和涂料。
试根据上述信息回答下列问题:
(1)A的化学式为________,每消耗1 mol A转移的电子为______ mol;
(2)F与丁单质也可以化合生成G,试写出该反应的离子方程式:__________________________________________________________________;
(3)化合物M与H组成元素相同,可以将G氧化为F,且不引进新的离子。试写出M在酸性环境下将G氧化为F的离子方程式:___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是:
A.2SO2+O2![]() 2SO3 ΔH=-196.6 kJ·mol-1
2SO3 ΔH=-196.6 kJ·mol-1
B.H2(g)+ ![]() O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ
D.C(s)+O2(g)=CO2(g) ΔH=+393.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中NO产生的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述不正确的是( )
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述不正确的是( )
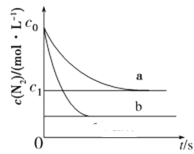
A.温度T下,该反应的平衡常数![]()
B.温度T下,随着反应的进行,混合气体的密度不变
C.曲线b对应的条件改变可能是增大压强
D.若曲线b对应的条件改变是温度,可判断该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究合成氨反应有重要意义,请完成下列探究:
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g)![]() H2(g) + CO(g) △H=+131.3kJ/mol,△S=+133.7J/(mol·K),该反应在低温下_______(填“能”或“不能”)自发进行。
H2(g) + CO(g) △H=+131.3kJ/mol,△S=+133.7J/(mol·K),该反应在低温下_______(填“能”或“不能”)自发进行。
(2)已知在 400℃时,N2(g) + 3H2(g) ![]() 2NH3(g)的 K=0.5
2NH3(g)的 K=0.5
①在400℃时,2NH3(g)![]() N2(g) + 3H2(g)的 K'=_________(填数值)。
N2(g) + 3H2(g)的 K'=_________(填数值)。
②400℃时,在 0.5L 的反应容器中进行合成氨反应,一段时间后,测得 N2、H2、NH3 的物质的量分别为 2mol、1mol、2mol,则此时反应 v(N2)正_____________ v(N2)逆(填 “>”、“<”、“=”或“不能确定”)。
③已 知 H—H 键 键 能 为 436kJ/mol , N—H 键 键 能 为 391kJ/mol , N N 键 键 能 为945.6kJ/mol,则反应N2(g)+ 3H2(g)![]() 2NH3(g)的△H= ____________。若在恒温、恒压条件下,向平衡体系中通入氩气,则平衡_____________(填“向左”、 “向右”或“不”)移动;使用催化剂_____________(填“增大”、“减小”或“不改变”)反 应的△H。
2NH3(g)的△H= ____________。若在恒温、恒压条件下,向平衡体系中通入氩气,则平衡_____________(填“向左”、 “向右”或“不”)移动;使用催化剂_____________(填“增大”、“减小”或“不改变”)反 应的△H。
(3)在 25℃下,将 a mol/L 的氨水和 0.01mol/L 的盐酸等体积混合,反应平衡时溶液中的 c(NH4+)=c(Cl-),则溶液显__________(填“酸”、“碱”或“中”)性;用含 a 的代数式表示 NH3H2O 电离常数 Kb= ______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
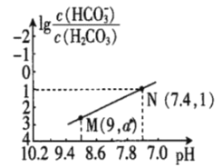
A.25℃时,H2CO3的一级电离K(H2CO3)=1.0×10-6.4
B.图中a=2.6
C.25℃时,HCO3-+H2O![]() H2CO3+OH-的Kh=1.0×10-7.6
H2CO3+OH-的Kh=1.0×10-7.6
D.M点溶液中:c(H+)+c(H2CO3)=c(Cl-)+2c(CO32-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol以CnHmCOOH所表示的羧酸加成时需50.8g碘,0.1mol该羧酸完全燃烧时,产生CO2和H2O共3.4mol,该羧酸是( )
A. C15H27COOHB. C15H31COOH
C. C17H31COOHD. C17H33COOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com