
【题目】下列热化学方程式书写正确的是:
A.2SO2+O2![]() 2SO3 ΔH=-196.6 kJ·mol-1
2SO3 ΔH=-196.6 kJ·mol-1
B.H2(g)+ ![]() O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ
D.C(s)+O2(g)=CO2(g) ΔH=+393.5 kJ·mol-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】三硫代碳酸钠(Na2CS3)在农业上用作杀菌剂和杀线虫剂,在工业上用于处理废水中的重金属离子。某化学兴趣小组对Na2CS3的一些性质进行探究。回答下列问题:
(1)在试管中加入少量三硫代碳酸钠样品,加水溶解,测得溶液pH=10,由此可知H2CS3是______(填“强”或“弱”)酸。向该溶液中滴加酸性KMnO4溶液,紫色褪去,由此说明Na2CS3具有______性。(填“还原”或“氧化”)。
(2)为了测定某Na2CS3溶液的浓度,按如图装置进行实验。将35.0 mL该Na2CS3溶液置于下列装置A的三颈烧瓶中,打开仪器d的活塞,滴入足量稀硫酸,关闭活塞。
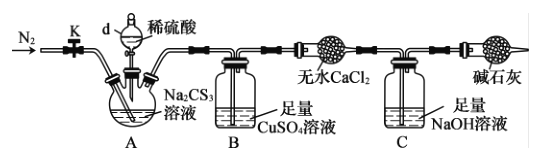
已知:CS32- +2H+==CS2 +H2S↑,CS2 和H2S均有毒;CS2不溶于水,沸点46°C,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
①仪器d的名称是__________。反应开始时需要先通入一段时间N2,其作用为______。
②B中发生反应的离子方程式是________。
③反应结束后。打开活塞K。再缓慢通入热N2(高于60°C)一段时间,其目的是__________。
④为了计算该Na2CS3溶液的浓度,可测定B中生成沉淀的质量。称量B中沉淀质量之前,需要进行的实验操作名称是过滤、_____、________;若B中生成沉淀的质量为8.4g,则该Na2CS3溶液的物质的量浓度是___________。
⑤若反应结束后将通热N2改为通热空气(高于60°C),通过测定C中溶液质量的增加值来计算三硫代碳酸钠溶液的浓度时,计算值______(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将等浓度的NaOH溶液分别滴加到等pH、等体积的HA、HB两种弱酸溶液中,溶液的pH与粒子浓度比值的对数关系如图所示。下列叙述错误的是( )
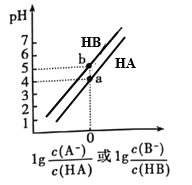
A. a点时,溶液中由水电离的c(OH-)约为1×10-10 mol·L-1
B. 电离平衡常数:Ka(HA)< Ka(HB)
C. b点时,c(B-)=c(HB)>c(Na+)>c(H+)>c(OH-)
D. 向HB溶液中滴加NaOH溶液至pH=7时:c(B-)> c(HB)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请写出下列有机化合物的结构简式和键线式。
(1) _______________、______________;
_______________、______________;
(2)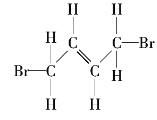 _______________、______________;
_______________、______________;
(3)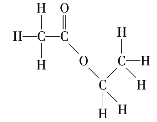 _______________、______________;
_______________、______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.常温下pH为2的醋酸溶液中由H2O电离出的H+数为10-12NA
B.标准状况下,28gCO与22.4LSO3所含分子数都为NA
C.50mL8mol/L的浓盐酸与足量的MnO2加热反应,生成Cl2的分子数为0.1NA
D.在反应S+2KNO3+3C![]() K2S+N2↑+3CO2↑中,每生成2NA个气体分子,参加反应的氧化剂的物质的量为1.5mol
K2S+N2↑+3CO2↑中,每生成2NA个气体分子,参加反应的氧化剂的物质的量为1.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据环保要求,在处理有氰电镀废水时,剧毒的CN-离子在催化剂TiO2颗粒作用下,先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用如图装置进行实验,测定CN-被处理的百分率。

现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.2mol/L)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出相关主要反应的离子方程式:甲中的反应:____,乙中的反应:____。
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。丙装置中的试剂是____,丁装置的目的是_____;干燥管Ⅱ的作用是_____。
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比_____(填“偏高”或“偏低”),简述可能的原因:_____。
(4)若干燥管Ⅰ中碱石灰增重1.408g,则该实验中测得CN-被处理的百分率为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在1800K时,2Fe(s)+3/2O2(g)=Fe2O3(s) H= -354.2kJ/mol;
3Fe(s)+2O2(g)=Fe3O4(s) H= -550.9kJ/mol
则反应:2Fe3O4(s)+1/2O2(g) === 3Fe2O3(s)的H =_____ kJ·mol1,四氧化三铁在充满氧气的集气瓶中反应生成Fe2O3_____(填“能”或“不能”)自发进行。
(2)2018年是合成氨工业先驱哈伯(PHaber)获得诺贝尔奖100周年。N2和H2生成NH3的反应为:1/2N2(g)+3/2H2(g) ![]() NH3(g) △H(298K)= - 46.2KJmol-1,在Fe催化剂作用下的反应历程如下(*表示吸附态)
NH3(g) △H(298K)= - 46.2KJmol-1,在Fe催化剂作用下的反应历程如下(*表示吸附态)
化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+ H*![]() NH*;NH*+ H*
NH*;NH*+ H*![]() NH2*;NH2* + H*
NH2*;NH2* + H*![]() NH3*
NH3*
脱附:NH3*![]() NH3(g)
NH3(g)
其中, N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。 请回答:
①利于提高合成氨平衡产率的条件有__________。
A.低温 B.高温 C.低压 D.高压 E.催化剂
②实际生产中,常用Fe作催化剂,控制温度773K,压强3.0 ×105Pa,原料中N2和H2物质的量之比为1:2.8。
分析说明原料气中N2过量的两个理由_________;_____________。
③关于合成氨工艺的下列理解,正确的是_______。
A.合成氨反应在不同温度下的△H和△S都小于零
B.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
C.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柳胺酚是一种药物,其常用的合成路线如图所示。回答下列问题:

已知:![]()
(1)柳胺酚的化学式为___________________。
(2)A→B反应所需的试剂是____________;B→C反应的化学方程式为_____________。
(3)D→E反应的有机反应类型是____________________;物质E中含有的官能团的名称是____________________________________。
(4)E和F反应的化学方程式为____________。
(5)写出同时符合下列条件的F的同分异构体的结构简式:_____________________。
①含有苯环;
②能发生银镜反应,不能发生水解反应;
③在稀NaOH溶液中,1 mol该同分异构体能与2mol NaOH溶液发生反应;
④苯环上有2种不同化学环境的氢原子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com