
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)熔融盐燃料电池具有高的发电效率,因而受到重视。可用熔融的碳酸盐作为电解质,向负极充入燃料气CH4,用空气与CO2的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。工作过程中,CO32-移向__(填“正”或“负”)极,已知CH4发生反应的电极反应式为CH4+4CO32--8e-=5CO2+2H2O,则另一极的电极反应式为___。
(2)利用上述燃料电池,按如图1所示装置进行电解,A、B、C、D均为铂电极,回答下列问题。

Ⅰ.甲槽电解的是200mL一定浓度的NaCl与CuSO4的混合溶液,理论上两极所得气体的体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计)。
①原混合溶液中NaCl的物质的量浓度为___,CuSO4的物质的量浓度为__。
②t2时所得溶液的pH=__。
Ⅱ.乙槽为200mLCuSO4溶液,乙槽内电解的总离子方程式:___;
①当C极析出0.64g物质时,乙槽溶液中生成的H2SO4为__mol。电解后,若使乙槽内的溶液完全复原,可向乙槽中加入__(填字母)。
A.Cu(OH)2 B.CuO
C.CuCO3 D.Cu2(OH)2CO3
②若通电一段时间后,向所得的乙槽溶液中加入0.2mol的Cu(OH)2才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为__。
【答案】负 O2+2CO2+4e-=2CO32-或2O2+4CO2+8e-=4CO32- 0.1molL-1 0.1molL-1 1 2Cu2++2H2O![]() 2Cu+O2↑+4H+ 0.01 BC 0.8NA
2Cu+O2↑+4H+ 0.01 BC 0.8NA
【解析】
(1)根据燃料电池的电极反应式进行分析;
(2)Ⅰ.电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,结合图可知,Ⅰ为阴极气体体积与时间的关系,Ⅱ为阳极气体体积与时间的关系。
Ⅱ.乙烧杯电解硫酸铜溶液,石墨为阳极,电极反应为4OH--4e-═O2↑+H2O,Cu为阴极,电极反应为Cu2++2e-═Cu,电解的总反应为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,结合反应进行分析。
2Cu+O2↑+2H2SO4,结合反应进行分析。
(1)甲烷燃料电池中,负极上甲烷被氧化,电极方程式为CH4+4CO32--8e-=5CO2+2H2O,正极发生的反应是氧气得电子的过程,电极反应为:O2+2CO2+4e-=2CO32-,生成的CO32-向负极移动;
答案为负;O2+2CO2+4e-=2CO32-或2O2+4CO2+8e-=4CO32-;
(2)Ⅰ.电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,结合图可知,Ⅰ为阴极气体体积与时间的关系,Ⅱ为阳极气体体积与时间的关系。
①由图可知,产生氯气为224mL,则由2Cl--2e-=Cl2↑可知,n(NaCl)=![]() ×2=0.02mol,所以c(NaCl)=
×2=0.02mol,所以c(NaCl)=![]() =0.1mol/L,由t2时生成氧气为112mL,n(O2)=
=0.1mol/L,由t2时生成氧气为112mL,n(O2)=![]() =0.005mol,则共转移电子为0.02mol+0.005mol×4=0.04mol,根据电子守恒及Cu2++2e-=Cu可知,n(CuSO4)=
=0.005mol,则共转移电子为0.02mol+0.005mol×4=0.04mol,根据电子守恒及Cu2++2e-=Cu可知,n(CuSO4)=![]() =0.02mol,所以c(CuSO4)=
=0.02mol,所以c(CuSO4)=![]() =0.1mol/L;
=0.1mol/L;
②由t2时4OH--4e-=O2↑+2H2O~4H+,n(H+)=0.005mol×4=0.02mol,则溶液的c(H+)=![]() =0.1mol/L,因此pH=-lg c(H+)=-lg0.1=1;
=0.1mol/L,因此pH=-lg c(H+)=-lg0.1=1;
Ⅱ.乙烧杯电解硫酸铜溶液,石墨为阳极,电极反应为4OH--4e-═O2↑+H2O,Cu为阴极,电极反应为Cu2++2e-═Cu,电解的总反应为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4;
2Cu+O2↑+2H2SO4;
①取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为![]() =0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,阳极反应的氢氧根离子的物质的量为0.2mol,生成的硫酸为0.1mol,根据电极方程式,电解过程中损失的元素有铜和氧,A、多加了H元素,错误;B、能够补充铜和氧元素,正确;C、CuCO3与硫酸反应放出二氧化碳,相当于加入了氧化铜,正确;D.Cu2(OH)2CO3多加了H元素,错误;故选BC;
=0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,阳极反应的氢氧根离子的物质的量为0.2mol,生成的硫酸为0.1mol,根据电极方程式,电解过程中损失的元素有铜和氧,A、多加了H元素,错误;B、能够补充铜和氧元素,正确;C、CuCO3与硫酸反应放出二氧化碳,相当于加入了氧化铜,正确;D.Cu2(OH)2CO3多加了H元素,错误;故选BC;
②加入0.2 mol Cu(OH)2后恰好恢复到电解前的浓度,Cu(OH)2从组成上可看成CuOH2O,根据“析出什么加入什么”的原则知,析出的物质是氧化铜和水,则阴极上析出氢气和铜,生成0.2mol铜转移电子个数=0.2mol×2 =0.4mol,根据原子守恒知,生成0.2mol水需要0.2mol氢气,生成0.2mol氢气转移电子的个数=0.2mol×2 =0.4mol,所以电解过程中共转移电子数为0.8mol,数目为0.8NA,故答案为:0.8NA。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】MnCO3可用作电器元件材料,也可作为瓷釉、颜料的制作原料。工业上用酸性含锰废水(主要含Mn2+、Cl-、H+、Fe2+、Cu2+)制备MnCO3:
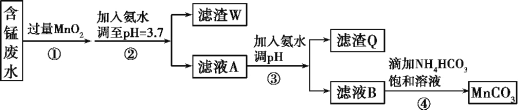
已知:几种金属离子沉淀的pH如下表。
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
完全沉淀的pH | 9.7 | 3.7 | 6.4 | 10.4 |
回答下列问题:
(1)①中加入过量MnO2的作用是___,滤渣W的成分是___。
(2)过程③中,调pH的目的是___。
(3)过程④中有CO2生成,则生成MnCO3的离子方程式是___。
(4)过程④中得到纯净MnCO3的操作方法是___,该过程中副产品的化学式是___。
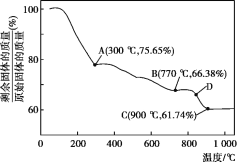
(5)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为___;图中点D对应固体的成分为___(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、三种元素,已知C原子最外层电子数为次外层电子数的3倍;B和C原子核外电子层数相等,而最外层电子数之和为10;A、C能形成AC型化合物,A2+离子和B原子电子层数也相同。回答:
(1)画出A2+离子的结构示意图 _____________________;
(2)A、B、C三元素符号分别为___________ 、_____________ 、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液只含下表离子中的几种,且各离子的物质的量浓度相等(不考虑水的电离与离子水解)。
阳离子 | K+、NH4+、Fe2+、Mg2+、Cu2+ |
阴离子 | OH-、Cl-、CO32-、SO42- |
某同学进行了如下实验(必要时可加热):

下列说法正确的是
A. 由沉淀A推断原溶液中一定含有SO42-
B. 原溶液中只含有NH4+、Fe2+、Cl-、SO42-
C. 滤液A中可能含有K+
D. 沉淀B中一定含有Mg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中产生的现象与对应的图形相符的是( )
A.  NaHSO3 粉末加入HNO3溶液中B.
NaHSO3 粉末加入HNO3溶液中B.  SO2气体通入新制氯水中
SO2气体通入新制氯水中
C.  NaOH溶液滴入 Ba(HCO3)2溶液中D.
NaOH溶液滴入 Ba(HCO3)2溶液中D.  CO2气体通入澄清石灰水中
CO2气体通入澄清石灰水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
Ⅰ.现有下列10种物质:①熔融的氢氧化钠②蔗糖③盐酸④金属钠⑤硫酸⑥二氧化硫⑦硫粉⑧石膏![]() ⑨酒精溶液⑩液氨
⑨酒精溶液⑩液氨
(1)属于电解质的是_______________(填序号,下同)。
(2)属于非电解质的是_____________。
(3)上述状态下能导电的是__________。
Ⅱ.已知某“84消毒液”瓶体部分标签如图所示。请回答下列问题:
84消毒液
[有效成分]![]()
[规格]![]()
[质量分数]25%
[密度]![]()
(1)![]() 的物质的量浓度约为________
的物质的量浓度约为________![]() (保留两位有效数字)。
(保留两位有效数字)。
(2)某同学参阅该“84消毒液”的配方,欲用![]() 固体配制
固体配制![]() 含
含![]() 质量分数为25%的消毒液。下列说法正确的是___________(填字母)。
质量分数为25%的消毒液。下列说法正确的是___________(填字母)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
![]()
![]()
![]()

![]()
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量![]() 固体的质量为
固体的质量为![]()
E.配制过程中,定容时俯视刻度线会使得溶液浓度偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
A. KClO3发生还原反应
B. H2C2O4在反应中被氧化
C. H2C2O4的氧化性强于C1O2的氧化性
D. 每1mol C1O2生成,该反应转移的电子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一定量饱和Ca(OH)2溶液中通入CO2气体后,产生CaCO3白色沉淀的质量与通入的CO2体积之间的关系曲线。请回答:
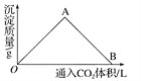
①OA段曲线所表示的化学反应方程式:_________,A点处已参加反应的CO2与Ca(OH)2的物质的量之比为________。
②B处溶液中存在的浓度较大的两种离子是________和________(填离子符号),将B处生成的溶液煮沸,可见到的现象是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.64 g SO2含有氧原子数为1NA
B.物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为1NA
C.标准状况下,22.4 L H2O的分子数为1NA
D.常温常压下,14 g N2含有分子数为0.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com