
【题目】如图为一定量饱和Ca(OH)2溶液中通入CO2气体后,产生CaCO3白色沉淀的质量与通入的CO2体积之间的关系曲线。请回答:
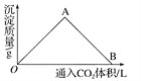
①OA段曲线所表示的化学反应方程式:_________,A点处已参加反应的CO2与Ca(OH)2的物质的量之比为________。
②B处溶液中存在的浓度较大的两种离子是________和________(填离子符号),将B处生成的溶液煮沸,可见到的现象是_____________。
【答案】Ca(OH)2+CO2=CaCO3↓+H2O 1∶1 Ca2+ HCO3— 溶液变浑浊(或产生白色沉淀)
【解析】
二氧化碳与氢氧化钙饱和溶液的反应与二氧化碳的量有关,少量二氧化碳与氢氧化钙反应生成碳酸钙和水,反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O,过量二氧化碳与氢氧化钙反应生成碳酸氢钙,反应的化学方程式为2CO2+Ca(OH)2=Ca(HCO3)2,由图可知OA段随着CO2通入CaCO3的量逐渐增大,A点达到沉淀最大值,AB段随CO2的通入,生成的CaCO3不断溶解转化为Ca(HCO3)2,B点CaCO3全溶解,溶液又变得澄清。
①由图可知OA段随着CO2通入CaCO3的量逐渐增大,A点达到沉淀最大值,则OA段发生的反应为二氧化碳与氢氧化钙反应生成碳酸钙和水,反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O,由方程式可知A点处已参加反应的二氧化碳和氢氧化钙的物质的量比为1:1,故答案为:CO2+Ca(OH)2=CaCO3↓+H2O;1:1;
②由图可知AB段随CO2的通入,生成的CaCO3不断溶解,发生的反应为二氧化碳与碳酸钙反应生成碳酸氢钙,则溶液中存在的浓度较大的两种离子是钙离子和碳酸氢根离子;将碳酸氢钙溶液煮沸,碳酸氢钙受热分解生成难溶的碳酸钙、二氧化碳和水,则可见到的现象是澄清溶液变浑浊,故答案为:Ca2+;HCO3— ;溶液变浑浊(或产生白色沉淀)。


科目:高中化学 来源: 题型:
【题目】G、W、X、Y、Z均为含氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转化关系(未配平):
①G![]() W+NaCl ②W+H2O
W+NaCl ②W+H2O![]() X+H2 ③Y+NaOH
X+H2 ③Y+NaOH![]() G+W+H2O ④Z+NaOH
G+W+H2O ④Z+NaOH![]() W+X+H2O这五种化合物中的氯的化合价由低到高的顺序是( )
W+X+H2O这五种化合物中的氯的化合价由低到高的顺序是( )
A.W、G、Z、Y、XB.G、Y、W、Z、X
C.G、Y、Z、W、XD.Z、X、G、Y、W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)熔融盐燃料电池具有高的发电效率,因而受到重视。可用熔融的碳酸盐作为电解质,向负极充入燃料气CH4,用空气与CO2的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。工作过程中,CO32-移向__(填“正”或“负”)极,已知CH4发生反应的电极反应式为CH4+4CO32--8e-=5CO2+2H2O,则另一极的电极反应式为___。
(2)利用上述燃料电池,按如图1所示装置进行电解,A、B、C、D均为铂电极,回答下列问题。

Ⅰ.甲槽电解的是200mL一定浓度的NaCl与CuSO4的混合溶液,理论上两极所得气体的体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计)。
①原混合溶液中NaCl的物质的量浓度为___,CuSO4的物质的量浓度为__。
②t2时所得溶液的pH=__。
Ⅱ.乙槽为200mLCuSO4溶液,乙槽内电解的总离子方程式:___;
①当C极析出0.64g物质时,乙槽溶液中生成的H2SO4为__mol。电解后,若使乙槽内的溶液完全复原,可向乙槽中加入__(填字母)。
A.Cu(OH)2 B.CuO
C.CuCO3 D.Cu2(OH)2CO3
②若通电一段时间后,向所得的乙槽溶液中加入0.2mol的Cu(OH)2才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。

请回答下列问题:
(1)实验室制取氨气的化学方程式为_________;
(2)装置A中的烧瓶内固体不可以选用________(选填序)
A.生石灰 B.碱石灰 C.五氧化二磷 D.烧碱
(3)装置F中发生反应的离子方程式是_________;
(4)B装置的作用_________;E装置的作用_________;
(5)若装置C内出现浓厚的白烟并在容器内壁凝结,且另一生成物是空气的主要成分之一。请写出反应的化学方程式:_________;
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,可以将尾气通入盛有_________溶液的烧杯来处理。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:X(g)+3Y(g)2Z(g),有关下列图象的说法正确的是
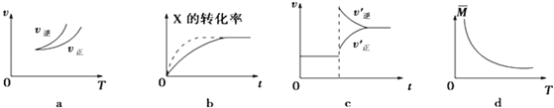
A.依据图a可判断正反应为吸热反应
B.在图b中,虚线可表示压强增大
C.若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动
D.由图d中气体平均相对分子质量随温度的变化情况,可推知正反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用反应:NaNO2+NH4Cl![]() NaCl+N2↑+2H2O制取少量氮气,下列关于该反应的说法不正确的是
NaCl+N2↑+2H2O制取少量氮气,下列关于该反应的说法不正确的是
A.N2既是氧化产物,又是还原产物
B.NH4Cl中氮元素被还原
C.被氧化的氮原子与被还原的氮原子的物质的量之比为1:1
D.每生成1 mol N2时,转移电子为3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiAlH4是重要的储氢材料,其组成类似于Na3AlF6。常见的供氢原理如下面两个方程式所示:①2LiAlH4![]() 2LiH+2Al+3H2↑,②LiAlH4+2H2O=LiAlO2+4H2↑。下列说法正确的是
2LiH+2Al+3H2↑,②LiAlH4+2H2O=LiAlO2+4H2↑。下列说法正确的是
A. 若反应①中生成3.36L氢气,则一定有2.7g铝生成
B. 氢化锂也是一种储氢材料,供氢原理为LiH+H2O=LiOH+H2↑
C. 生成等质量的氢气,反应①②转移电子数之比为4:3
D. LiAlH4是共价化合物,LiH是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,含有少量氧化铁,利用明矾石制备K2SO4的工艺流程如图所示:

据此流程图回答下列问题:
(1)①焙烧炉中Al2(SO4)3与S反应的产物是两种氧化物,该反应的化学方程式为______;写出炉气的一种用途________。
(2)②中Al2O3参与反应的离子方程式为__________。
(3)③中调节pH不能用CO2的理由是____________________。
(4)工业冶炼金属铝需要定期更换补充阳极碳块的原因是__________________。
(5)纯净氢氧化铝经历两次__________________(填反应类型)可制得铝。以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池负极的电极反应式是__________________。
(6)现有明矾石1 625 t,按上述流程制得780 t Al(OH)3,忽略铝元素的损失,请计算明矾石中钾元素的质量分数为____________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘海醇为非离子型造影剂,适用于有造影剂反应的高危因素的病人。下面是以化合物A为原料合成碘海醇的路线:
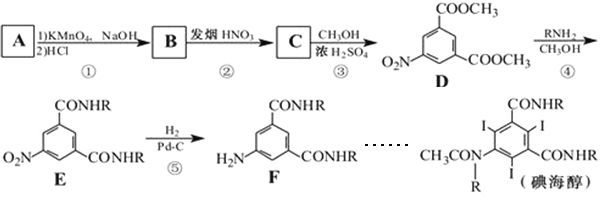
其中R-为-CH2CH(OH)CH2OH
请回答以下问题:
(1)物质D中含有的官能团为________。
(2)A是苯的同系物,相对分子量为106,则A的结构简式是_______________。
(3)写出A的侧链与氯气发生一氯取代的条件_____________。
(4)反应②的化学方程式______________。
(5)反应①→⑤中,属于氧化反应的是_____________(填序号)。
(6)写出能同时满足下列条件的D的两种同分异构体的结构简式:_________。
Ⅰ.苯环上有3个取代基,苯环上的一卤代物有2种;
Ⅱ.能发生银镜反应,水解产物之一能与FeCl3溶液发生显色反应;
Ⅲ.含有1个α-氨基酸的结构(例如:CH3CH(NH2)COOH属于α-氨基酸)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com