
| A. | X只能是第三周期元素 | B. | a-b+n+m的和只可能等于10 | ||
| C. | b大于5 | D. | Y可能是第二周期元素 |
分析 X和Y均为短周期元素,已知aXn-比bYm+多两个电子层,X可能为二、三周期元素,Y可能为一、二周期元素,如X为第二周期元素,则Y只能为第一周期元素,则Y只能为H,X可能为N、O、F等,如Y为第二周期元素,可为Li、Be等元素,则X可能为S、Cl等元素,以此解答该题.
解答 解:X和Y均为短周期元素,已知aXn-比bYm+多两个电子层,X可能为二、三周期元素,Y可能为一、二周期元素,如X为第二周期元素,则Y只能为第一周期元素,则Y只能为H,X可能为N、O、F等,如Y为第二周期元素,可为Li、Be等元素,则X可能为S、Cl等元素.
A.X可能为二、三周期元素,如Y为第一周期元素,则X可为第二周期元素,Y为第二周期元素,则X为第三周期元素,故A错误;
B.aXn-比bYm+多两个电子层,如Y为第一周期元素,则X为第二周期元素,a+n-b+m=10,如Y为第二周期元素,则X为第三周期元素,a+n-b+m=18-2=16,故B错误;
C.由以上分析可知Y可能为H、Li、Be等元素,则b<5,故C错误;
D.由以上分析可知,Y可为Li、Be等,可能第二周期元素,故D正确.
故选:D.
点评 本题考查原子结构与元素的性质,侧重于学生的分析能力的考查,注意把握原子结构与元素在周期表中的位置的关系,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 强酸溶液中:K+、Fe2+、MnO4-、SO42- | |
| B. | $\frac{{K}_{w}}{c(O{H}^{-})}$=0.1mol/L的溶液:Na+、K+、SiO32-、NO3- | |
| C. | 既能溶解Al(OH)3又能溶解 H2SiO3的溶液中:Na +、CO32-、SO32-、NO3- | |
| D. | 在含有大量HCO3-的溶液中:K+、Na+、AlO2-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂为KMnO4,其中Cl元素被还原 | |
| B. | 若有0.8molH2O生成,则反应中有NA个电子转移 | |
| C. | 浓HCl在反应中起酸性和还原性的作用 | |
| D. | 氧化剂与还原剂的物质的量之比为1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -8Q kJ•mol-1 | B. | +16Q kJ•mol-1 | C. | +8Q kJ•mol-1 | D. | -16Q kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温pH=3的硫酸与pH=11的LiOH溶液等体积混合溶液呈碱性,说明LiOH为强碱 | |
| B. | 用明矾净水是因为Al3+水解生成的Al(OH)3胶粒能凝聚水中的悬浮物 | |
| C. | 除去MgCl2溶液中的FeCl3,可向其中加入MgCO3 | |
| D. | 除去锅炉水垢中的CaSO4,可加入Na2CO3溶液将其转化为CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
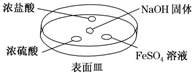
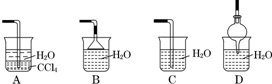


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
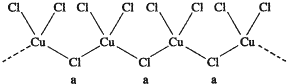 铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域.一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO).
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域.一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO). 杂化轨道类型sp2
杂化轨道类型sp2 杂化轨道类型sp3.
杂化轨道类型sp3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 | |
| B. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| C. | 用可见光束照射以区别溶液和胶体 | |
| D. | H+、K+、S2-、Br-能在Fe(OH)3胶体中大量共存 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com