
����Ŀ����һ���������ܱ������м���2 mol A��0.6 mol C��һ������B������������һ�������·�����Ӧ��������Ũ����ʱ��仯�������ͼ����ʾ��ͼ��Ϊt2ʱ�̺�ı䷴Ӧ��������ƽ����ϵ�з�Ӧ������ʱ��仯����������ĸ��ζ����ı�һ�ֲ�ͬ����������֪t3��t4��ʹ���˴�����ͼ����t0��t1��c(B)�ı仯���δ������

����˵������ȷ����( )
A. �÷�ӦΪ���ȷ�Ӧ B. B��t0��t1�ε�ת����Ϊ60%
C. t4��t5�θı������Ϊ��Сѹǿ D. t1ʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��K��![]()
���𰸡�B
��������t3��t4����t4��t5�����淴Ӧ���ʶ���ȣ���t3��t4��Ϊʹ�ô�������t4��t5�θı������Ϊ���ͷ�Ӧ�¶ȣ�ƽ���ƶ������ƶ��������淴Ӧ���ʲ���ȣ���t4��t5��ӦΪ��Сѹǿ�����÷�ӦΪ�����������ķ�Ӧ����Ӧ��A��Ũ�ȱ仯Ϊ1mol/L-0.8mol/L=0.2mol/L��C��Ũ�ȱ仯Ϊ0.6mol/L-0.3mol/L=0.3mol/L����A��C�Ļ�ѧ������֮��Ϊ2��3���ָ÷�ӦΪ�����������ķ�Ӧ����BΪ��Ӧ��÷�ӦΪ2A��g��+B��g��3C��g����t5��t6�θı������Ϊ���߷�Ӧ�¶ȣ�ƽ�����������ƶ���������ӦΪ���ȷ�Ӧ��A. �÷�ӦΪ���ȷ�Ӧ��ѡ��A��ȷ��B��A����0.2mol/L����B����0.1mol/L������ʼB��Ũ��Ϊ0.1mol/L+0.4mol/L=0.5mol/L����B��t0��t1�ε�ת����Ϊ![]() ��ѡ��B����ȷ��C��t4��t5�θı������Ϊ��Сѹǿ��ѡ��C��ȷ��D��t1ʱ�����ʵ�ƽ��Ũ��Ϊ0.8mol/L��0.4mol/L��0.6mol/L���÷�Ӧ�Ļ�ѧƽ�ⳣ��K��
��ѡ��B����ȷ��C��t4��t5�θı������Ϊ��Сѹǿ��ѡ��C��ȷ��D��t1ʱ�����ʵ�ƽ��Ũ��Ϊ0.8mol/L��0.4mol/L��0.6mol/L���÷�Ӧ�Ļ�ѧƽ�ⳣ��K��![]() ��ѡ��D��ȷ����ѡB��
��ѡ��D��ȷ����ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��ˮ�ĵ���ﵽƽ�⣺H2O![]() H����OH������H��0������������ȷ����
H����OH������H��0������������ȷ����
A����ˮ�м���ϡ��ˮ��ƽ�������ƶ���c(OH��)����
B����ˮ�м������������������ƣ�c(H��)����Kw����
C����ˮ�м����������ᣬƽ�������ƶ���c(OH��)����
D����ˮ���ȣ�Kw����pH���䣬������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ�����еĶ�������Ͱ�����������Ի�����������Ҫ���塣
��1����������������ˮ������ˮ��������Һ��H2SO3��HSO3-��SO32- ռ�������������ı�����pH�ı仯����ͼ��ʾ����ͼ��֪H2SO3 �ĵ���ƽ�ⳣ��Ka1=____________��

��2����������[CO��NH2��2]ˮ�����Һ�������պ�SO2 �Ŀ�������֪����ˮ����ȣ�������ˮ�ⷴӦ������ˮ��ķ�Ӧ����ʽ����:CO��NH2��2+H2O=H2NCOONH4���������������
�ٰ�������炙�������е�SO2 ��O2 ��Ӧ������NH4��2SO4,�÷�Ӧ�Ļ�ѧ����ʽΪ__________��
��һ��������,��������Һ���պ�SO2 �Ŀ��������SO2 ������������Һ���¶ȱ仯��ͼ����ʾ���¶ȸ���60 ��ʱ��SO2 �������������ߵ�ԭ����_____________��
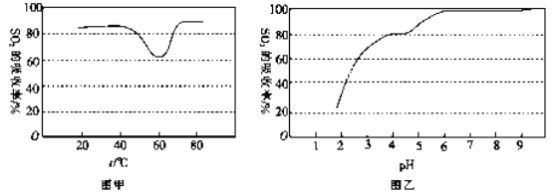
��������Һ����SO2 ������������Һ��pH�仯��ͼ����ʾ��������Һ���պ�SO2�Ŀ�������Һ��pH�ή�ͣ�Ϊ���SO2 �������ʺͳ�ֻ��ղ���������Һ�м���_____������Һ��������������pH Ϊ_______��
��3��һ�ֵ绯ѧ��������ԭ����ͼ��ʾ��
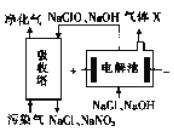
�ٵ��������������ĵ缫��ӦΪ_____________��
����ͬ������ͨ�����Ⱦ�������ɵ�X �������Ϊ40 :3,��Ⱦ����NO ��NO2 ռ�������10%����NaClO��ȫ��Ӧ����Ⱦ����NO��NO2 ����ȫ�������������岻���뷴Ӧ����NO��NO2 �������Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(SeO2)��һ�����������䱻��ԭ��ĵ��������ܳ�Ϊ������Ⱦ�ͨ����ŨHNO3��ŨH2SO4��Ӧ����SeO2�Ի���Se��
��֪����Se��2H2SO4(Ũ)===2SO2����SeO2��2H2O��
��2SO2��SeO2��2H2O===Se��2SO42����4H+��
(1) Se��ŨH2SO4�ķ�Ӧ�У���������________________����ԭ����_______________�����б�״����22.4 L SO2��������ʱ��ת�Ƶ��ӵ����ʵ�����________ mol��
(2)���ݷ�Ӧ�������ж�SeO2��ŨH2SO4��SO2����������ǿ������˳����______________________��
(3)�õ����ŷ������Ӧ�ڵ���ת�Ƶķ������Ŀ��_____________________________��
(4)SeO2��KI��HNO3�������·�Ӧ��SeO2��KI��HNO3�D��Se��I2��KNO3��H2O��ƽ������Ӧ�Ļ�ѧ����ʽ______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йؽ�����ʴ�������˵����ȷ����( )

A. ͼ1�У����뺣ˮ�е�������Խ�����ˣ���ʴԽ����
B. �Ʋ������п���ȶ�����������
C. �����������ڿ�������绯ѧ��ʴ�����䰵
D. ͼ2�У�������X��ΪCu����ʹ���ڵ��µĸֹ����ܸ�ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ijЩ�������ȡ���ռ���β������װ������ͼ��ʾ��ʡ�Լгֺ;���װ�ã������ô�װ�úͱ����ṩ������������ʵ�飬�������ѡ����

ѡ�� | A�е����� | B�е����� | C���ռ������� | D�е����� |
A | Ũ��ˮ | CaO | NH3 | H2O |
B | Ũ���� | MnO2 | Cl2 | NaOH��Һ |
C | ϡ���� | Cu | NO2 | H2O |
D | Ũ���� | Na2SO3 | SO2 | NaOH��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�д��ڵ���ƽ��CH3COOH![]() H����CH3COO��������������ȷ���ǣ� ��
H����CH3COO��������������ȷ���ǣ� ��
A. �����¶ȣ�ƽ�������ƶ�������ĵ��볣��Kaֵ����
B. 0.10mol/L��CH3COOH��Һ�м�ˮϡ�ͣ���Һ���������ӵ�Ũ�ȶ���С
C. ����Һ�м�������CH3COONa���壬ƽ�������ƶ���c��CH3COO������Ũ�ȼ�С
D. 25��ʱ����������Ũ���ᣬƽ�������ƶ�������ĵ���̶�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£�wgij���������������г��ȼ�գ���ȼ�ղ��������������Na2O2��Ӧ��������������wg������H2����CO����CO��H2�Ļ���� ��HCHO����CH3COOH����HO-CH2-CH2-OH�У������������
A. �������� B. ֻ���٢ڢ� C. ֻ���ܢ� D. ȫ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������pC����Һ�������ʵ���Ũ�ȵĸ������������£�һ��Ũ�ȵ�ij��(H2A)ˮ��Һ��pC(H2A)��pC(HA��)��pC(A2-)������ҺpH�ı仯������ͼ��ʾ������˵��һ����ȷ����

A. pH=4ʱ��c(HA��)<c(A2-)
B. c(H2A)+c(HA��)+c(A2-)�Ƕ�ֵ
C. ����ĵ��볣��Ka1=10-1.3
D. �����£�NaHA��ˮ��Һ�ʼ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com