
вбжЊ:2CH3OH(g) CH3OCH3(g)+H2O(g) ІЄH=-25 kJ/mol ФГЮТЖШЯТЕФЦНКтГЃЪ§ЮЊ400ЁЃДЫЮТЖШЯТЃЌдк1 LЕФУмБеШнЦїжаМгШыCH3OHЃЌЗДгІЕНФГЪБПЬВтЕУИїзщЗжЕФЮяжЪЕФСПХЈЖШШчЯТЃК
CH3OCH3(g)+H2O(g) ІЄH=-25 kJ/mol ФГЮТЖШЯТЕФЦНКтГЃЪ§ЮЊ400ЁЃДЫЮТЖШЯТЃЌдк1 LЕФУмБеШнЦїжаМгШыCH3OHЃЌЗДгІЕНФГЪБПЬВтЕУИїзщЗжЕФЮяжЪЕФСПХЈЖШШчЯТЃК

ЯТСаЫЕЗЈе§ШЗЕФЪЧ( )
ЂйЦНКтКѓЩ§ИпЮТЖШЃЌЦНКтГЃЪ§ЃО400
ЂкЦНКтЪБЃЌc(CH3OCH3)=1.6 mol/L
ЂлЦНКтЪБЃЌЗДгІЛьКЯЮяЕФзмФмСПМѕЩй20 kJ
ЂмЦНКтЪБЃЌдйМгШыгыЦ№ЪМЕШСПЕФCH3OHЃЌДяаТЦНКтКѓCH3OHзЊЛЏТЪдіДѓ
ЂнДЫЪБПЬЗДгІДяЕНЦНКтзДЬЌ
ЂоЦНКтЪБCH3OHЕФХЈЖШЮЊ0.08 molЁЄL-1
A.ЂйЂкЂмЂн B.ЂкЂо
C.ЂкЂлЂмЂо D.ЂкЂмЂо
B
ЁОНтЮіЁПвђЮЊе§ЗДгІЮЊЗХШШЗДгІЃЌЩ§ИпЮТЖШЦНКтГЃЪ§МѕаЁЃЌЂйДэЃЛИљОнБэИёЪ§ОнПЩжЊЃЌЗДгІзЊЛЏЩњГЩЕФCH3OCH3ЁЂH2OХЈЖШОљЮЊ1.24 molЁЄL-1ЃЌДЫЪБCH3OHЕФХЈЖШЮЊ0.8 molЁЄL-1ЃЌИљОн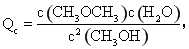 НЋИїЮяжЪЕФХЈЖШДњШыПЩЕУЃЌQc=2.4ЃМ400ЃЌЫљвдДЫЪБУЛгаДяЕНЦНКтЃЌДЫЪБЗДгІЯђе§ЗДгІЗНЯђНјааЃЌЂнДэЃЛгЩЛЏбЇЦНКтГЃЪ§МЦЫуПЩжЊЦНКтЪБc(CH3OCH3)=1.6 mol/LЃЌЂкЖдЃЛЩњГЩCH3OCH3ЕФЮяжЪЕФСПЮЊ1.6 molЃЌИљОнЗНГЬЪНПЩжЊЩњГЩ1.6 mol CH3OCH3ЗХГіЕФШШСПЮЊ1.6 molЁС25 kJЁЄmol-1=40 kJЃЌЂлДэЃЛЦНКтЪБЃЌдйМгШыгыЦ№ЪМЕШСПЕФCH3OHЃЌЯрЕБгкдіДѓбЙЧПЃЌЦНКтВЛвЦЖЏ,CH3OHЕФзЊЛЏТЪВЛБфЃЌЂмДэЃЛИљОнЂкПЩжЊЃЌДяЕНЦНКтЪБCH3OHЕФХЈЖШЮЊ0.8 molЁЄL-1-0.72 molЁЄL-1=0.08 molЁЄL-1ЃЌЂоЖдЁЃ
НЋИїЮяжЪЕФХЈЖШДњШыПЩЕУЃЌQc=2.4ЃМ400ЃЌЫљвдДЫЪБУЛгаДяЕНЦНКтЃЌДЫЪБЗДгІЯђе§ЗДгІЗНЯђНјааЃЌЂнДэЃЛгЩЛЏбЇЦНКтГЃЪ§МЦЫуПЩжЊЦНКтЪБc(CH3OCH3)=1.6 mol/LЃЌЂкЖдЃЛЩњГЩCH3OCH3ЕФЮяжЪЕФСПЮЊ1.6 molЃЌИљОнЗНГЬЪНПЩжЊЩњГЩ1.6 mol CH3OCH3ЗХГіЕФШШСПЮЊ1.6 molЁС25 kJЁЄmol-1=40 kJЃЌЂлДэЃЛЦНКтЪБЃЌдйМгШыгыЦ№ЪМЕШСПЕФCH3OHЃЌЯрЕБгкдіДѓбЙЧПЃЌЦНКтВЛвЦЖЏ,CH3OHЕФзЊЛЏТЪВЛБфЃЌЂмДэЃЛИљОнЂкПЩжЊЃЌДяЕНЦНКтЪБCH3OHЕФХЈЖШЮЊ0.8 molЁЄL-1-0.72 molЁЄL-1=0.08 molЁЄL-1ЃЌЂоЖдЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2014ФъЛЏбЇИпПМЬтаЭзЈСЗСљ ИЧЫЙЖЈТЩгІгУгыШШЛЏбЇЗНГЬЪНЕФЪщаДСЗЯАОэЃЈНтЮіАцЃЉ ЬтаЭЃКбЁдёЬт
дк298 KЁЂ100 kPaЪБЃЌвбжЊЃК
2H2O(g)=O2(g)ЃЋ2H2(g)ЁЁІЄH1
Cl2(g)ЃЋH2(g)=2HCl(g)ЁЁІЄH2
2Cl2(g)ЃЋ2H2O(g)=4HCl(g)ЃЋO2(g)ЁЁІЄH3
дђІЄH3гыІЄH1КЭІЄH2МфЕФЙиЯЕе§ШЗЕФЪЧ (ЁЁЁЁ)ЁЃ
AЃЎІЄH3ЃНІЄH1ЃЋ2ІЄH2 BЃЎІЄH3ЃНІЄH1ЃЋІЄH2
CЃЎІЄH3ЃНІЄH1Ѓ2ІЄH2 DЃЎІЄH3ЃНІЄH1ЃІЄH2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2014ФъЛЏбЇИпПМЬтаЭзЈСЗЦп ЕчЛЏбЇРэТлЕФЗжЮіМАгІгУСЗЯАОэЃЈНтЮіАцЃЉ ЬтаЭЃКбЁдёЬт
ФГжжОлКЯЮяяЎРызгЕчГиЗХЕчЪБЕФЗДгІЮЊLi1ЃxCoO2ЃЋLixC6=6CЃЋLiCoO2ЃЌЦфЕчГиШчЭМЫљЪОЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ (ЁЁЁЁ)ЁЃ
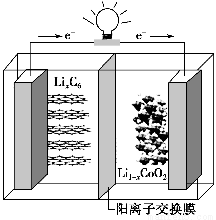
AЃЎЗХЕчЪБЃЌLixC6ЗЂЩњбѕЛЏЗДгІ
BЃЎГфЕчЪБЃЌLiЃЋЭЈЙ§бєРызгНЛЛЛФЄДгзѓЯђгввЦЖЏ
CЃЎГфЕчЪБНЋЕчГиЕФИКМЋгыЭтНгЕчдДЕФИКМЋЯрСЌ
DЃЎЗХЕчЪБЃЌЕчГиЕФе§МЋЗДгІЮЊLi1ЃxCoO2ЃЋxLiЃЋЃЋxeЃ=LiCoO2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2014ФъЛЏбЇИпПМПЮЪБбнСЗ10МзЭщввЯЉБНУКЪЏгЭЬьШЛЦјЕФзлКЯРћгУСЗЯАОэЃЈНтЮіАцЃЉ ЬтаЭЃКбЁдёЬт
ЯТСагыгаЛњЮяНсЙЙЁЂаджЪЯрЙиЕФа№ЪіДэЮѓЕФЪЧ( )
A.ввЫсЗжзгжаКЌгаєШЛљЃЌПЩгыNaHCO3ШмвКЗДгІЩњГЩCO2
B.ЕААзжЪКЭгЭжЌЖМЪєгкИпЗжзгЛЏКЯЮяЃЌвЛЖЈЬѕМўЯТФмЫЎНт
C.МзЭщКЭТШЦјЗДгІЩњГЩвЛТШМзЭщЃЌБНКЭЯѕЫсЗДгІЩњГЩЯѕЛљБНЕФЗДгІРраЭЯрЭЌ
D.БНВЛФмЪЙфхЕФЫФТШЛЏЬМШмвКЭЪЩЋЃЌЫЕУїБНЗжзгжаУЛгагыввЯЉЗжзгжаРрЫЦЕФЬМЬМЫЋМќ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2014ФъЛЏбЇИпПМПЮЪБбнСЗ10МзЭщввЯЉБНУКЪЏгЭЬьШЛЦјЕФзлКЯРћгУСЗЯАОэЃЈНтЮіАцЃЉ ЬтаЭЃКбЁдёЬт
ЖдЯТСаЛЏбЇгУгяЕФРэНте§ШЗЕФЪЧ( )
AЃЎРызгНсЙЙЪОвтЭМ МШПЩвдБэЪО35Cl-ЃЌвВПЩвдБэЪО37Cl-
МШПЩвдБэЪО35Cl-ЃЌвВПЩвдБэЪО37Cl-
BЃЎЕчзгЪН МШПЩвдБэЪОєЧЛљЃЌвВПЩвдБэЪОЧтбѕИљРызг
МШПЩвдБэЪОєЧЛљЃЌвВПЩвдБэЪОЧтбѕИљРызг
CЃЎБШР§ФЃаЭ МШПЩвдБэЪОМзЭщЗжзгЃЌвВПЩвдБэЪОЫФТШЛЏЬМЗжзг
МШПЩвдБэЪОМзЭщЗжзгЃЌвВПЩвдБэЪОЫФТШЛЏЬМЗжзг
DЃЎНсЙЙМђЪН(CH3)2CHCH3МШПЩвдБэЪОе§ЖЁЭщЃЌвВПЩвдБэЪОвьЖЁЭщ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2014ФъЛЏбЇИпПМПЮЪБбнСЗ 7-3ЛЏбЇЦНКтГЃЪ§ЛЏбЇЗДгІНјааЗНЯђСЗЯАОэЃЈНтЮіАцЃЉ ЬтаЭЃКбЁдёЬт
25ЁцЪБЃЌдкКЌгаPb2+ЁЂSn2+ЕФФГШмвКжаЃЌМгШыЙ§СПН№ЪєЮ§(Sn)ЃЌЗЂЩњЗДгІ:Sn(s)ЃЋPb2ЃЋ(aq) Sn2ЃЋ(aq)ЃЋPb(s)ЃЌЬхЯЕжаc(Pb2+)КЭc(Sn2+)БфЛЏЙиЯЕШчЭМЫљЪОЁЃЯТСаХаЖЯе§ШЗЕФЪЧ( )
Sn2ЃЋ(aq)ЃЋPb(s)ЃЌЬхЯЕжаc(Pb2+)КЭc(Sn2+)БфЛЏЙиЯЕШчЭМЫљЪОЁЃЯТСаХаЖЯе§ШЗЕФЪЧ( )
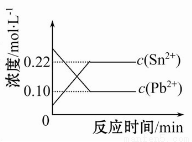
A.ЭљЦНКтЬхЯЕжаМгШыЩйСПН№ЪєЧІКѓЃЌc(Pb2+)діДѓ
B.ЭљЦНКтЬхЯЕжаМгШыЩйСПSn(NO3)2ЙЬЬхКѓЃЌc(Pb2+)БфаЁ
C.Щ§ИпЮТЖШЃЌЦНКтЬхЯЕжаc(Pb2+)діДѓЃЌЫЕУїИУЗДгІІЄHЃО0
D.25ЁцЪБЃЌИУЗДгІЕФЦНКтГЃЪ§K=2.2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2014ФъЛЏбЇИпПМзмИДЯАПЮЪБбнСЗ9-2ЕчНтГиН№ЪєЕчЛЏбЇИЏЪДгыЗРЛЄСЗЯАОэЃЈНтЮіАцЃЉ ЬтаЭЃКбЁдёЬт
ЭМжаXЮЊЕчдДЃЌYЮЊНўЭИБЅКЭЪГбЮЫЎКЭЗгЬЊЪдвКЕФТЫжНЃЌТЫжНжабыЕЮгавЛЕЮKMnO4ШмвКЃЌЭЈЕчКѓYжабыЕФзЯКьЩЋАпЯђdЖЫРЉЩЂЁЃЯТСаХаЖЯе§ШЗЕФЪЧ( )
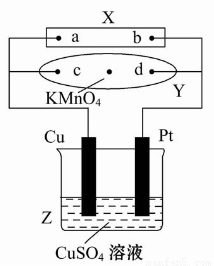
A.ТЫжНЩЯcЕуИННќЛсБфКьЩЋ
B.CuЕчМЋжЪСПМѕаЁЃЌPtЕчМЋжЪСПдіДѓ
C.ZжаШмвКЕФpHЯШМѕаЁЃЌКѓдіДѓ
D.ШмвКжаЕФSO42-ЯђCuЕчМЋЖЈЯђвЦЖЏ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2014ФъЛЏбЇИпПМзмИДЯАПЮЪБбнСЗ3-4Н№ЪєВФСЯгУЭО Н№ЪєПѓЮяРћгУСЗЯАОэЃЈНтЮіАцЃЉ ЬтаЭЃКбЁдёЬт
ЯТСагаЙиДПЬњЕФа№Ъіе§ШЗЕФЪЧЃЈ ЃЉ
AЃЎШлЕуБШЩњЬњЕФЕЭ
BЃЎгыЯрЭЌХЈЖШЕФбЮЫсЗДгІЩњГЩЧтЦјЕФЫйТЪБШЩњЬњЕФПь
CЃЎдкРфЕФХЈСђЫсжаПЩвдЖлЛЏ
DЃЎдкГБЪЊПеЦјжаБШЩњЬњШнвзБЛИЏЪД
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2014ФъЛЏбЇИпПМзмИДЯАПЮЪБбнСЗ 8-3бЮРрЕФЫЎНтСЗЯАОэЃЈНтЮіАцЃЉ ЬтаЭЃКбЁдёЬт
дк0.1 mol/LЕФДзЫсФЦШмвКжаМгШыЕШЬхЛ§ЕФЯТСаЮяжЪЃЌШмвКжаРызгХЈЖШДѓаЁЙиЯЕе§ШЗЕФЪЧ( )
A.ЫЎЃЛc(CH3COO-)ЃОc(Na+)ЃОc(OH-)ЃОc(H+)
B.0.1 mol/LбЮЫсЃЛc(Na+)=c(Cl-)ЃОc(H+)ЃОc(CH3COO-)ЃОc(OH-)
C.0.1 mol/LДзЫсЃЛc(Na+)ЃОc(CH3COO-)ЃОc(H+)ЃОc(OH-)
D.0.1 mol/LЧтбѕЛЏФЦЃЛc(Na+)ЃОc(CH3COO-)ЃОc(OH-)ЃОc(H+)
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com