
����Ŀ������ʵ��������գ�
��1����ͬѧ��������װ��������ͭ��Ũ���ᷴӦʵ�飮 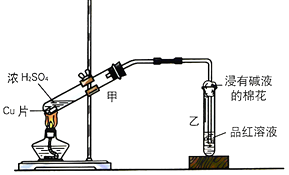
��д����װ���з�������Ҫ��Ӧ�Ļ�ѧ����ʽ ��
����ͬѧ��Ϊ����Ҫ��ͭ��ȡ����ͭ����������ͭ��������Ӧ��������ͭ��Ȼ����������ͭ��ϡ���ᷴӦ���Եõ�����ͭ����Ҫ��ȡ����ͭ������ӻ��������ͽ�Լ��Դ�ĽǶȷ������Ƚϼ�ͬѧ����ͬѧ��ȡ����ͭ�ķ����и��������� �� ԭ���� �� 
��2����ͬѧ������ͼ�ķ���ʵ������ȡ����֤SO2ijЩ���ʣ�����ʵ�������¼�ڱ��У���������±���
װ����� | ʵ����������� | ʵ����ۻ�ѧ����ʽ |
�� | �����ݲ��� | ��ѧ����ʽΪ�� |
�� | ��ɫʯ����Һ��ɫ | ֤��SO2����ˮ������ |
�� | Ʒ����Һ��ɫ | ֤��SO2������ |
�� | ��Һ����� | ֤��SO2������ |
�� | ��ˮ��ɫ | ֤��SO2������ |
�� | ����β�� | ֤��SO2������������ |
���𰸡�
��1��Cu+2H2SO4![]() CuSO4+SO2��+2H2O���ң����ж����������,��Ⱦ����,������Ⱦ,���������ʸ�
CuSO4+SO2��+2H2O���ң����ж����������,��Ⱦ����,������Ⱦ,���������ʸ�
��2��Na2SO3+H2SO4��Ũ��=Na2SO4+H2O+SO2�����죻Ư�ף���������ԭ����
���������⣺��1����ͭ��Ũ���ᷴӦ��������ͭ�Ͷ����������壬��Ӧ�Ļ�ѧ����ʽΪ��Cu+2H2SO4 ![]() CuSO4+SO2��+2H2O�����Դ��ǣ�Cu+2H2SO4
CuSO4+SO2��+2H2O�����Դ��ǣ�Cu+2H2SO4 ![]() CuSO4+SO2��+2H2O��
CuSO4+SO2��+2H2O��
�ڼ������ɶ���������������һ���ж����壬���Լ�������ȡ��ͨ�������֪������ͬ����������ͭ���ҷ������ĵ������٣��Ƚ�Լ��ԭ�ϣ��ֲ���Ⱦ������
���Դ��ǣ��ң����ж��������������Ⱦ������������Ⱦ�����������ʸߣ���2������Ϊ�������ƺ�Ũ���ᷴӦ���ɶ����������壬��Ӧ�Ļ�ѧ����ʽΪ��Na2SO3+H2SO4��Ũ��=Na2SO4+SO2��+H2O��
���Դ��ǣ�Na2SO3+H2SO4��Ũ��=Na2SO4+H2O+SO2����
������������ˮ��ˮ��Ӧ���������ᣬ������Ϊ���ᣬ����ʹ��ɫʯ����Һ��죬
���Դ��ǣ���ɫ��
�۶���������Ʒ�컯��������ɫ���ʣ���ʹƷ����Һ��ɫ���ʶ����������Ư���ԣ�
���Դ��ǣ�Ư���ԣ�
��SO2��+4��S���������ԣ������Щ�2��S���л�ԭ�ԣ����������ܰ����������ɵ�����������ԭ�ɵ�����Ӧ����ʽΪSO2+2H2S=3S��+2H20��
���Դ��ǣ�������
�ݶ���������л�ԭ�ԣ��ܹ�����ˮ����������ԭ��Ӧ��������������ᣬ��ˮ��ɫ��
���Դ��ǣ���ԭ��
���������ж�������ֱ���ŷŵ������У��������������������ܹ����������Ʒ�Ӧ�����������ƺ�ˮ�����Դ��ǣ��ᣮ


 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��136C��146C��̼Ԫ�ص����ֺ��أ����Ǿ��в�ͬ��
A. ������B. ������C. ������D. ��������Ų�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. Ԫ�����ڱ���Ԫ�������������Ԫ�ص����ԭ������
B. ����������ͨ�����������γ����Ӽ�
C. Ԫ�����ڱ���ʮ�˸����У�Ҳ����ʮ������
D. ֻ���ڻ��ý���Ԫ�غͻ��÷ǽ���Ԫ�ػ���ʱ�������γ����Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ʵ�����˵������ȷ���� (����)
A. ���ʵ����ǹ��ʵ�λ���е��߸�����������֮һ
B. ���ʵ���ʵ���Ͼ������ʵ�����
C. ���ʵ�����һ���������ĵ�λ
D. Ħ���������ʵ����ĵ�λ���������������ĵ�λ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��C��O��S���γɶ��ֻ������CO2��CS2��COS�ȣ�
��1��������˵��̼��������Ԫ�طǽ��������ǿ������������ţ���
a����ͬ������ˮ��Һ��pH��Na2CO3��Na2SO4
b�����ԣ�H2SO3��H2CO3
c��CS2��̼Ԫ��Ϊ+4�ۣ���Ԫ��Ϊ��2��
��2���ʻ���COS������Ϊһ��Ѭ�������ܷ�ֹijЩ���桢�߳��Σ��������ӽṹ��CO2���ƣ��ʻ���COS���ĵ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������
��1���£�N2H4������Ϊ�����������ȼ�ϣ���������N2O4��Ӧ����N2��ˮ������
��֪����N2��g��+2O2��g��=N2O4 ��g����H1=��195kJmol��1
��N2H4 ��1��+O2��g��=N2��g��+2H2O��g����H2=��534.2kJmol��1
д���º�N2O4 ��Ӧ���Ȼ�ѧ����ʽ��
��2����һ����ȼ�ϵ����һ�ּ��Ե�أ�����Ⱦ�������ߣ��й㷺��Ӧ��ǰ�����乤��ԭ����ͼ��ʾ���ش��������⣺ 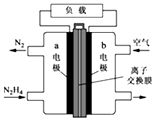
�ٸ�ȼ�ϵ�صĸ��������ķ�ӦʽΪ ��
�ڵ�ع���ʱ��OH������������a����b����
�۵���طŵ�ת��5mol����ʱ����������ȼ����g��
��3��LiCoO2������һ������ӵ�ص��������ϣ�������ӵ�س������У����������ķ�ӦΪ6C+xLi++xe���TLixC6 �� ��������LiCoO2��Li1��xCoO2֮���ת����д���ŵ�ʱ����ܷ�Ӧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��ʵ�����н�������ʵ�飺
��� | �� | �� | �� |
ʵ�� |
|
|
|
���� | û�����Ա仯����Һ��Ϊ��ɫ | �а�ɫ�������ɣ���ҺΪ��ɫ | ����ɫ����ų� |
���½�����ȷ����( )
A.���������Ա仯��˵������Һ����Ӧ
B.���еİ�ɫ����ΪCuCl2
C.���е����ӷ���ʽΪ2H����Zn=Zn2����H2��
D.���з����ķ�Ӧ�������ӷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������������Һ�д����������( )
A.Na+��Mg2+��Cl��OH
B.H+��Ca2+�� ![]() ��
�� ![]()
C.Cu2+��K+�� ![]() ��
�� ![]()
D.Na+�� ![]() ��OH��Ca2+
��OH��Ca2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ����м��㣬ֱ��д����������
��1����״���£�2.24L Cl2������Ϊg��
��2��10.8g R2O5����ԭ�ӵ���ĿΪ3.01��1023 �� ��Ԫ��R�����ԭ������Ϊ ��
��3����ȼ����ʽ̼����þ��OH����CO32������֮��Ϊ51��300�������������ӵ����ʵ���֮��Ϊ ��
��4����10mL1.00mol/L Na2CO3��Һ��10mL1.00mol/L CaCl2��Һ���ͣ�������Һ��Na+�����ʵ���Ũ��Ϊmol/L�����Ի��ǰ����Һ����ı仯����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com