
【题目】2009年《化学教育》期刊封面刊载如图所示的有机物M(只含C、H、O)的球棍模型图。不同大小、颜色的小球代表不同的原子,小球之间的“棍”表示共价键,既可以表示三键,也可以表示双键,还可以表示单键。下列有关M的推断正确的是( )
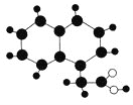
A. M的分子式为C12H12O2
B. M与足量氢气在一定条件下反应的产物的环上一氯代物有7种
C. M能发生中和反应、取代反应
D. 一个M分子最多有11个原子共面
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在3个1.0 L的恒容密闭容器中分别进行反应2X(g)+Y(g)![]() Z(g) ΔH,达到平衡。相关数据如下表。
Z(g) ΔH,达到平衡。相关数据如下表。
容器 | 温度/K | 物质的起始浓度/ mol·L-1 | 物质的平衡浓度/ mol·L-1 | ||
c(X) | c(Y) | c(Z) | c(Z) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | a |
III | 500 | 0.20 | 0.10 | 0 | 0.025 |
下列说法不正确的是
A. 平衡时,X的转化率:II>I
B. 平衡常数:K(II)>K(I)
C. 达到平衡所需时间:III<I
D. 反应的ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
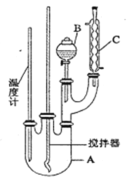
【题目】某科学小组制备硝基苯的实验装置如下,有关数据列如下表。已知存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯。
物质 | 熔点/℃ | 沸点/℃ | 密度/g.cm-1 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
实验步骤如下:
取100mL烧杯,用20 mL浓硫酸与足量浓硝酸配制混和酸,将混合酸小心加入B中。把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀。在50~60℃下发生反应,直至反应结束。
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210℃馏分,得到纯硝基苯18g。
回答下列问题:
(1)图中装置C的作用是_______________________________。
(2)制备硝基苯的化学方程式__________________________________________________。
(3)叙述配制混合酸操作:______________________________________________。
(4)为了使反应在50℃~60℃下进行,常用的方法是______________。反应结束并冷却至室温后A中液体就是粗硝基,粗硝基苯呈黄色的原因是________________________(用化学方程式说明),除去该有色物质选择的试剂是____________,分离提纯的方法为___________,涉及的离子方程式为_______________。
(5)在洗涤操作中,第二次水洗的作用是________________________________________。
(6)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用水直形冷凝管的原因是_______________________________________________________________。
(7)本实验所得到的硝基苯产率是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向苯酚钠溶液中滴加NaHSO3溶液,溶液变浑浊 | 苯酚酸性弱于H2SO3酸性 |
B | 向AgNO3溶液中逐滴加入浓度均为0.05 mol·L-1的NaI、NaCl混合溶液,有黄色沉淀生成 | Ksp(AgCl)>Ksp(AgI) |
C | 向FeCl3溶液中加入Cu粉,Cu粉溶解 | Cu的还原性大于Fe |
D | 向盛有H2O2溶液的试管中滴几滴酸化的FeCl2溶液,溶液变成棕黄色,一段时间后,溶液中有气泡出现 | 铁离子催化H2O2的分解 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各选项中,各类物质依次表示为X、Y、Z,其中与图中三个圆所示的从属关系不相符的是:

A. 氧化物、化合物、纯净物
B. 碱性氧化物、金属氧化物、氧化物
C. 胶体、分散系、混合物
D. 复分解反应、置换反应、化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,

写出A、B、C、D、E、F的化学式: A.____,B.____,C._____,D._____,E._____,F.______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol·L-1 NaOH溶液450 mL。根据溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是 _____________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器 _____________________。
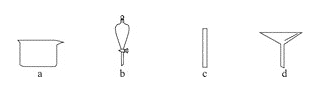
(2)配制时,其正确的操作顺序是(用字母表示,每个操作只用一次) __________。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(3)实验两次用到玻璃棒,其作用分别是:先用于 ______,后用于 ________。
(4)关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是 ________。
A.①②③④ B.②③ C.①②④ D.②③④
(5)根据计算用托盘天平称取的质量为 ____________g。
(6)下列操作配制的溶液浓度偏低的是______。
A.称量NaOH时,将NaOH放在纸上称重
B.配制前,容量瓶中有少量蒸馏水
C.配制时,NaOH未冷却直接定容
D.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
E.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以电镀废渣(Cr2O3、CuO、Fe2O3及CaO)为原料制取铜粉和K2Cr2O7的主要流程如图:
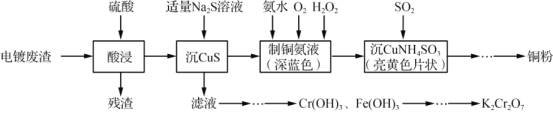
(1)“酸浸”时,所得残渣的主要成分是___________。
(2)“沉 CuS”时,加入的硫化钠必须适量,若过量可能产生的后果是_________(用离子方程式表示)。
(3)一水合硫酸四氨合铜加热到650℃可分解为铜、氨气、二氧化硫和水以及一种无污染气体,写出其化学方程式___________。
(4)“沉CuNH4 SO3”时可用如图装置(夹持、加热仪器略):
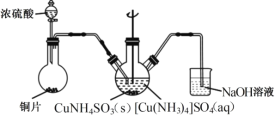
①“沉CuNH4SO3”时,反应液需控制在45℃,合适的加热方式是____________。
②NaOH溶液的作用是___________。
(5)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.0g配成250 mL溶液,用移液管取出25.00 mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000mol·L–1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复进行二次实验。(已知Cr2O72-被还原为Cr3+)
①若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL,则所得产品K2Cr2O7的纯度为_____%。[已知M(K2Cr2O7)=294g·mol-1,计算结果保留至小数点后两位]。
②上述流程中K2Cr2O7发生氧化还原反应后所得溶液中除含有Cr3+外,还含有一定浓度的 Fe3+杂质,可通过加碱调pH的方法使两者转化为沉淀。已知c(Cr3+)=2×10–5 mol·L-1,则当溶液中开始析出Cr(OH)3沉淀时Fe3+是否沉淀完全?____________(通过计算说明原因)。{已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物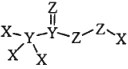 是一种高效消毒剂,其蒸汽和溶液都具有很强的杀菌能力,可用于目前新冠病毒疫情下的生活消毒。其中X、Y、Z 为原子序数依次增大的短周期元素。下列叙述正确的是
是一种高效消毒剂,其蒸汽和溶液都具有很强的杀菌能力,可用于目前新冠病毒疫情下的生活消毒。其中X、Y、Z 为原子序数依次增大的短周期元素。下列叙述正确的是
A.原子半径:X>Y>Z
B.元素的非金属性:X<Y<Z
C.该化合物中Z的化合价均呈-2 价
D.该化合物中 X、Y、Z都满足 8 电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com