
【题目】下列酸中,酸性最强的是( )
A.HClO
B.HNO2
C.H2SO4
D.HClO4
科目:高中化学 来源: 题型:
【题目】化学中有许多有趣的实验,如下介绍的“蓝瓶子”实验就是一例。 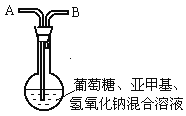
在250 mL平底烧瓶中依次加入2g氢氧化钠、100mL蒸馏水、2g葡萄糖(粉末),振荡使其溶解。滴入4~6滴0.2%的亚甲基蓝溶液,塞上瓶塞(如图),振荡烧瓶,溶液呈蓝色。静置,约3分钟后蓝色消失,变为无色。再次振荡,无色溶液又呈蓝色。可反复多次。为探究是什么原因引起的,有人做了以下实验。
①从烧瓶中取出溶液注满一支试管,塞上橡皮塞。试管中的溶液由蓝色变为无色,再振荡试管溶液不能变蓝。
②在原烧瓶中经A处鼓入空气,又慢慢变蓝了。静置片刻后,蓝色又消失。再次鼓入空气,又慢慢变蓝。
③为了进一步弄清是何种成分引起的,他又继续探索。从A处改通纯净的N2、CO2 , 都不能使烧瓶中的无色溶液变蓝。把制得的氧气从A处通入,发现上述无色溶液慢慢变为蓝色,到此为止,“蓝瓶子”实验原理有了科学结论,请总结“蓝瓶子”实验的变色原理:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以磷石膏(只要成分CaSO4 , 杂质SiO2、Al2O3等)为原料可制备轻质CaCO3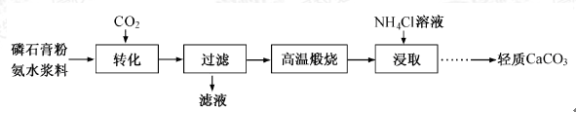
(1)
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为 和 (填化学式);检验洗涤是否完全的方法是 。
(3)在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下: 
已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4 , TiOSO4遇水会水解.
请回答下列问题:
(1)操作1用到的玻璃仪器除烧杯外还有 , 操作2是、过滤,副产品主要成分的化学式为
(2)请结合化学用语解释将TiO2+转化为H2TiO3的原理
(3)已知钛的还原性介于铝和锌之间,估计钛能耐腐蚀的原因之一是 , 如果可从Za、Zn、Fe三种金属中选一种金属代替流程中的镁,那么该金属跟四氯化钛反应的化学方程式是
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解质,用碳块作电解槽,其阴极反应的电极反应式为
(5)为测定溶液中TiOSO4的含量,首先取待测钛液10mL用水稀释至100mL,加过量铝粉,充分振荡,使其完全反应:3TiO2++Al+6H+═3Ti3++AlO3++3H2O,过过滤后,取出滤液20.00mL,向其中滴加2~3滴KSCN溶液作指示剂,用(填一种玻璃仪器的名称)滴加0.1000molL﹣1FeCl3溶液,发生Ti3++Fe3+═Ti4++Fe2+ , 当溶液出现红色达到滴定终点,用去了30.00mLFeCl3溶液,待测钛液中TiOSO4的物质的量浓度是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学通过如下实验探究反应原理并验证产物。
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深。
(1)该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为。
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[xMg(OH)2yMgCO3]
(2)为了确定产物成份(包括产生的气体、白色不溶物及溶液中溶质),进行以下定性实验。请填写表中空白:
实验序号 | 实 验 | 实验现象 | 结 论 |
实验Ⅱ | 将实验I中收集到的气体点燃 | 安静燃烧,火焰呈淡蓝色 | 气体成分为① |
实验Ⅲ | 将实验I中的白色不溶物滤出、洗涤,取少量加入足量② | ③ | 白色不溶物中含有MgCO3 |
实验Ⅳ | 取实验Ⅲ中的滤液,向其中加入适 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO32-离子 |
(3)为进一步确定实验I中白色不溶物的成分,进行以下定量实验,装置如图所示: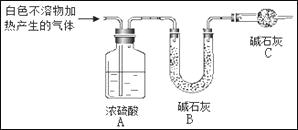
称取干燥、纯净的白色不溶物 4.52 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重0.36 g,装置B增重1.76 g。
①装置C的作用是;
②白色不溶物的化学式为。
(4)根据以上(2)及(3)的定性定量实验,写出镁与饱和碳酸氢钠溶液反应的化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定碳酸钙粉末的纯度(含杂质SiO2),某学校学生设计了如下几个实验方案:
方案一:①称取碳酸钙样品M g;②加入过量盐酸;③收集并测定生成的气体体积V mL。
方案二:①称取碳酸钙样品M g;②用c mol/L盐酸V mL(过量)溶解样品;③取溶解后的溶液用c′mol/L NaOH溶液滴定,恰用去V′ mL。
方案三:①称取碳酸钙样品M g;②高温1000 ℃煅烧直至质量不再改变,冷却后称量,质量为M′ g。
方案四:①称取碳酸钙样品M g;②加入足量c mol/L盐酸V mL使之完全溶解;③过滤并取滤液;④在滤液中加入过量的c′mol/L Na2CO3溶液V′mL;⑤将步骤④中的沉淀滤出,洗涤、干燥、称量为M′g。
依据以上实验方案回答以下问题:
(1)方案一中如果称量样品时,砝码底部有一处未被发现的残缺,那么测得的碳酸钙纯度会(填“偏高”、“偏低”或“无影响”)。
(2)方案二中:列出本实验中所用到的仪器名称(除铁架台、烧杯、铁架台附件外)?
(3)方案三中的“冷却”应如何操作:;
理由是。
(4)方案四中计算碳酸钙纯度的公式为;步骤⑤中要将沉淀进行洗涤,如果未经洗涤,则测定结果碳酸钙纯度将(填“偏高”、“偏低”或“无影响”)。
(5)综上所述,请从实验条件的难易、操作引起实验误差的大小等方面进行综合判断,你认为四个方案中,最好的方案是。其他方案的缺点分别是:
方案四:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差。
方案:。
方案:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,弱酸的电离平衡常数如表:下列有关说法正确的是( )
弱酸 | CH3COOH | HCN | H2CO3 |
Ka | 1.8×10﹣8 | 4.9×10﹣10 | K1;4.3×10﹣7 |
A.等物质的量浓度的各溶液的pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol/L HCN与b mol/L NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN﹣),则a一定小于b
C.往冰醋酸中逐滴加水,溶液导电能力先增大,后减小
D.NaHCO3和Na2CO3的混合液中:c(Na+)+c(H+)=c(OH﹣)+c(HCO ![]() )+c(CO
)+c(CO ![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.化学键是分子间的强烈的相互作用
B.离子键是阴、阳离子间的强烈的相互作用
C.共价键只存在于非金属元素的原子之间
D.共价键一定只存在于共价化合物中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbO2、KMnO4、Cl2、FeCl3、CuCl2的氧化性依次减弱。下列反应不可能发生的是
A. Cu+2Fe3+==Cu2++2Fe2+ B. 10Cl-+2MnO![]() +16H+=2Mn2++5Cl2↑+8H2O
+16H+=2Mn2++5Cl2↑+8H2O
C. Cu+Cl2![]() CuCl2 D. 5Pb2++2MnO
CuCl2 D. 5Pb2++2MnO![]() +2H2O=5PbO2↓+2Mn2++4H+
+2H2O=5PbO2↓+2Mn2++4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com