
【题目】钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下: 
已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4 , TiOSO4遇水会水解.
请回答下列问题:
(1)操作1用到的玻璃仪器除烧杯外还有 , 操作2是、过滤,副产品主要成分的化学式为
(2)请结合化学用语解释将TiO2+转化为H2TiO3的原理
(3)已知钛的还原性介于铝和锌之间,估计钛能耐腐蚀的原因之一是 , 如果可从Za、Zn、Fe三种金属中选一种金属代替流程中的镁,那么该金属跟四氯化钛反应的化学方程式是
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解质,用碳块作电解槽,其阴极反应的电极反应式为
(5)为测定溶液中TiOSO4的含量,首先取待测钛液10mL用水稀释至100mL,加过量铝粉,充分振荡,使其完全反应:3TiO2++Al+6H+═3Ti3++AlO3++3H2O,过过滤后,取出滤液20.00mL,向其中滴加2~3滴KSCN溶液作指示剂,用(填一种玻璃仪器的名称)滴加0.1000molL﹣1FeCl3溶液,发生Ti3++Fe3+═Ti4++Fe2+ , 当溶液出现红色达到滴定终点,用去了30.00mLFeCl3溶液,待测钛液中TiOSO4的物质的量浓度是 .
【答案】
(1)漏斗、玻璃棒;蒸发浓缩、冷却结晶;FeSO4
(2)溶液中存在平衡:TiO2++2H2OH2TiO3+2H+ , 当加热升温后,平衡正向移动,生成H2TiO3
(3)钛表面形成一层致密的氧化膜(或钛的内部结构紧密);TiCl4+4Na ![]() Ti+4NaCl
Ti+4NaCl
(4)TiO2 +4e﹣=Ti+2O2﹣
(5)酸式滴定管;1.50 molL﹣1
【解析】解:用浓硫酸处理钛铁矿,并向所得溶液中加入大量水稀释后加入过量铁粉还原铁离子,过滤得到滤液通过蒸发浓缩,冷却结晶,过滤得到TiO2+滤液,和副产品FeSO4 , 滤液中加入水加热过滤得到H2TiO3 , H2TiO3加热灼烧得到TiO2 , 加入氯气、过量碳高温加热反应生成TiCl4和一氧化碳,四氯化钛和金属镁高温加热反应得到氯化镁和钛金属.(1)操作1为过滤用到的玻璃仪器除烧杯外还有漏斗、玻璃棒,操作2的实验步骤为:蒸发浓缩、冷却结晶,加入过量铁屑后溶液中含有Fe2+离子,则过滤后可得FeSO47H2O(或FeSO4),副产品主要成分的化学式为FeSO4 , 故答案为:漏斗、玻璃棒;蒸发浓缩、冷却结晶;FeSO4;(2)加热的目的是促进TiO2+水解生成H2TiO3 , 分离出固体加热得到TiO2;溶液中存在平衡:TiO2++2H2OH2TiO3+2H+ , 当加热升温后, 平衡正向移动,生成H2TiO3;
故答案为:溶液中存在平衡:TiO2++2H2OH2TiO3+2H+ , 当加热升温后,平衡正向移动,生成H2TiO3;(3)钛的还原性介于铝与锌之间,氧化铝是一层致密的氧化膜,估计钛能耐腐蚀的原因钛表面形成一层致密的氧化膜(或钛的内部结构紧密);活泼金属钠可以将金属钛置换出来:TiCl4+4Na ![]() Ti+4NaCl,Zn、和Fe都是不可以的,活泼性差,
Ti+4NaCl,Zn、和Fe都是不可以的,活泼性差,
故答案为:钛表面形成一层致密的氧化膜(或钛的内部结构紧密);TiCl4+4Na ![]() Ti+4NaCl;(4)因TiO2作阴极,得到电子,被还原,TiO2 +4e﹣=Ti+2O2﹣ , 得到单质Ti,
Ti+4NaCl;(4)因TiO2作阴极,得到电子,被还原,TiO2 +4e﹣=Ti+2O2﹣ , 得到单质Ti,
故答案为:TiO2 +4e﹣=Ti+2O2﹣;(5)准确滴加氯化铁溶液可使用滴定管,氯化铁有较强的氧化性,应用酸式滴定管;
设滤液Ti3+的物质的量为x,
Ti3+(紫色)+ | Fe3++H2O=TiO2+(无色)+Fe2++2H+ |
1 | 1 |
x | 0.1000molL﹣1×0.03L |
解得x=0.1000molL﹣1×0.03L=0.003mol
则待测钛液中TiOSO4的物质的量=0.003mol×5=0.015mol
根据c= ![]() =
= ![]() =1.50 molL﹣1 ,
=1.50 molL﹣1 ,
故答案为:酸式滴定管;1.50 molL﹣1 .
用浓硫酸处理钛铁矿,并向所得溶液中加入大量水稀释后加入过量铁粉还原铁离子,过滤得到滤液通过蒸发浓缩,冷却结晶,过滤得到TiO2+滤液,和副产品FeSO4 , 滤液中加入水加热过滤得到H2TiO3 , H2TiO3加热灼烧得到TiO2 , 加入氯气、过量碳高温加热反应生成TiCl4和一氧化碳,四氯化钛和金属镁高温加热反应得到氯化镁和钛金属,(1)操作1为过滤,操作2的实验步骤为:蒸发浓缩、冷却结晶,加入过量铁屑后溶液中含有Fe2+离子,依据原子守恒可知产物为硫酸亚铁,则过滤后可得FeSO47H2O(或FeSO4),滤渣为过量的铁屑和不溶物脉石;(2)依据溶液中存在平衡:TiO2++2H2OH2TiO3+2H+ , 平衡影响因素和平衡移动原理分析判断;(3)根据金属铝的氧化物的性质结合信息来回答,金属钠的活泼性强,可以用于金属的冶炼;(4)根据电解原理:阴极上是发生得电子的还原反应;(5)准确滴加氯化铁溶液可使用酸式滴定管;根据元素守恒计算待测钛液中TiOSO4的物质的量.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】化学反应原理在科研和生产中有广泛应用。
(1)用生物质热解气(主要成分为CO、CH4、H2)将SO2在一定条件下还原为单质硫进行烟气脱硫。已知:
①C(s)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1
②CO2(g)+C(s)=2CO(g) △H2= + 172.5 kJ·mol-1
③S(s)+O2(g)=SO2(g) △H3=- 296.0 kJ·mol-1
CO将SO2 还原为单质硫的热化学方程式为_____________________________________。
(2)CO可用于合成甲醇,一定温度下,向体积为2 L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),达到平衡后测得各组分的浓度如下:
CH3OH(g),达到平衡后测得各组分的浓度如下:
物质 | CO | H2 | CH3OH |
浓度(mol·L-1) | 0.9 | 1.0 | 0.6 |
①反应达到平衡时,CO的转化率为_______________。
②该反应的平衡常数K=________________。
③恒温恒容条件下,可以说明反应已达到平衡状态的是__________(填标号)。
A.v正(CO)=2v逆(H2) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化
④若将容器体积压缩到1L,则达到新平衡时c(H2)的取值范围是_____________。
⑤若保持容器体积不变,再充入0.6molCO和0.4molCH3OH,此时v正__________v逆(填“>”<”或“=”)。
(3)常温下,HNO2的电离常数Ka=7.1×10-4mol·L-1,NH3·H2O的电离常数Kb=1.7×10-5mol·L-1。0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是__________,常温下NO2-水解反应的平衡常数Kb=__________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氧化性:Cl2>Fe3+>I2>S,在强酸性溶液中,下列各组离子能大量共存的是( )
A.Na+、K+、I﹣、Cl﹣B.Na+、I﹣、SO42﹣、Fe3+
C.Ba2+、K+、HCO3﹣、NO3﹣D.Ba2+、Na+、SO42﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是
A. 加入KSCN溶液一定不变红色 B. 溶液中一定含Fe2+
C. 溶液中一定不含Cu2+ D. 剩余固体中一定含Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(s)+2B(g)3C(g),下列能作为反应达到平衡状态的标志的是( )
A.恒温恒容时,体系的压强不再变化
B.消耗2molB的同时生成3molC
C.2v(B)=3v(C)
D.A、B、C三种物质共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用,某化学研究性学习小组设计并完成了如下实验.
测定过碳酸钠样品(含有的杂质不溶于水且不与酸反应)的纯度.
实验原理2Na2CO4+4HCl═4NaCl+2CO2↑+O2↑+2H2O
实验装置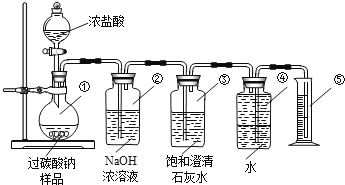
交流与讨论
Ⅰ.甲同学认为测定产物中O2的体积即可测定样品的纯度.
(1)装置②的作用是:;
(2)装置③的作用是:;
(3)称取适量样品与足量浓盐酸充分反应后,收集到的氧气的体积为0.25L(已知该实验条件下氧气的密度为1.28g/L),则称取的样品质量应大于g;
(4)Ⅱ.乙同学认为测定产物中CO2的质量(即反应前后装置②的质量差)就可测定样品的纯度.但利用上述实验装置测得CO2的质量并计算样品的纯度,结果会偏高,你认为原因可能是();(填序号)
A.浓盐酸易挥发,产生的氯化氢气体被装置②吸收
B.二氧化碳气体逸出时带出的水蒸气在装置②中冷凝而被吸收
C.装置①、②内空气中的二氧化碳被装置②吸收
(5)Ⅲ.丙同学提出了一种新方案,得到了大家的一致认可:称取样品12.5g,滴加足量浓盐酸至样品反应完全,再将烧瓶中所有的液体蒸发、结晶、烘干,称得氯化钠固体11.7g.则该样品的纯度为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com