
【题目】下列物质属于强电解质的是( )
A.蔗糖B.铜C.稀硫酸D.硫酸钡晶体
科目:高中化学 来源: 题型:
【题目】太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.
(1)基态硅原子的电子排布式
(2)有一类组成最简单的有机硅化合物叫硅烷.硅烷的组成、结构与相应的烷烃相似.硅烷中硅采取 杂化方式,硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是 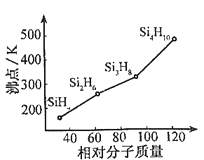
(3)硒和硫同为VIA族元素,与其相邻的元素有砷和溴,则三种元素的电负性由小到大的顺序为 .(用元素符号表示)
(4)气态SeO3分子的立体构型为 ,与SeO3互为等电子体的一种离子为 (填化学式).
(5)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为 ;若该晶体的晶胞棱长为a pm,则该合金密度为 g/cm3 . (列出计算式,不要求计算结果,阿伏伽德罗常数的值为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中有许多有趣的实验,如下介绍的“蓝瓶子”实验就是一例。 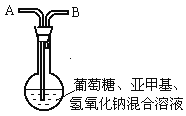
在250 mL平底烧瓶中依次加入2g氢氧化钠、100mL蒸馏水、2g葡萄糖(粉末),振荡使其溶解。滴入4~6滴0.2%的亚甲基蓝溶液,塞上瓶塞(如图),振荡烧瓶,溶液呈蓝色。静置,约3分钟后蓝色消失,变为无色。再次振荡,无色溶液又呈蓝色。可反复多次。为探究是什么原因引起的,有人做了以下实验。
①从烧瓶中取出溶液注满一支试管,塞上橡皮塞。试管中的溶液由蓝色变为无色,再振荡试管溶液不能变蓝。
②在原烧瓶中经A处鼓入空气,又慢慢变蓝了。静置片刻后,蓝色又消失。再次鼓入空气,又慢慢变蓝。
③为了进一步弄清是何种成分引起的,他又继续探索。从A处改通纯净的N2、CO2 , 都不能使烧瓶中的无色溶液变蓝。把制得的氧气从A处通入,发现上述无色溶液慢慢变为蓝色,到此为止,“蓝瓶子”实验原理有了科学结论,请总结“蓝瓶子”实验的变色原理:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制0.2 mol·L-1的NaCl溶液,下列操作会导致所配溶液的物质的量浓度偏高的是
A. 称量时,左盘高,右盘低 B. 定容时俯视读取刻度
C. 原容量瓶洗净后未干燥 D. 转移溶液时未洗涤烧杯2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七铝十二钙 (12CaO·7Al2O3)是一种新型的超导材料和发光材料,它是用一定量的CaCO3溶解于酸性AlCl3溶液,再用氨水沉淀,然后煅烧沉淀制备。工业上制备七铝十二钙的流程如下图: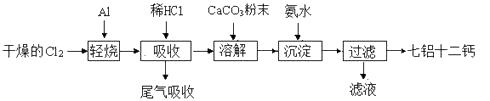
(1)轻烧后产生的AlCl3蒸气易凝华,为防止堵塞导气管可采取的措施为。
(2)吸收时用稀盐酸溶解的原因是。
(3)AlCl3溶液溶解CaCO3时,要控制碳酸钙和AlCl3的量,要求n(CaCO3)∶n(AlCl3)> 12∶14,其原因是。但若加入CaCO3过多,会产生的后果是。
(4)沉淀、过滤后的滤液主要成分是。
(5)以工业碳酸钙(含有少量Al2O3、Fe3O4杂质)生产二水合氯化钙(CaCl2·2H2O)的方法为:将工业碳酸钙溶于盐酸,加入双氧水, , 冰水洗涤,干燥,得到CaCl2·2H2O(实验中需用到的试剂和仪器有:盐酸,双氧水,氢氧化钙,冰水,pH计)。
已知:几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算):
开始沉淀的pH | 完全沉淀的pH | |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.5 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原子结构的说法正确的是( )
A.所有原子都含有质子、中子和电子3种基本微粒
B.质子数决定元素的种类,中子数决定原子的种类
C.质子、中子和电子不可以进一步分成更小的微粒
D.1H、2H2、3H+不能互称为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以磷石膏(只要成分CaSO4 , 杂质SiO2、Al2O3等)为原料可制备轻质CaCO3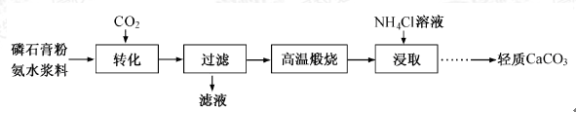
(1)
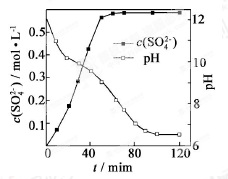
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为 和 (填化学式);检验洗涤是否完全的方法是 。
(3)在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下: 
已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4 , TiOSO4遇水会水解.
请回答下列问题:
(1)操作1用到的玻璃仪器除烧杯外还有 , 操作2是、过滤,副产品主要成分的化学式为
(2)请结合化学用语解释将TiO2+转化为H2TiO3的原理
(3)已知钛的还原性介于铝和锌之间,估计钛能耐腐蚀的原因之一是 , 如果可从Za、Zn、Fe三种金属中选一种金属代替流程中的镁,那么该金属跟四氯化钛反应的化学方程式是
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解质,用碳块作电解槽,其阴极反应的电极反应式为
(5)为测定溶液中TiOSO4的含量,首先取待测钛液10mL用水稀释至100mL,加过量铝粉,充分振荡,使其完全反应:3TiO2++Al+6H+═3Ti3++AlO3++3H2O,过过滤后,取出滤液20.00mL,向其中滴加2~3滴KSCN溶液作指示剂,用(填一种玻璃仪器的名称)滴加0.1000molL﹣1FeCl3溶液,发生Ti3++Fe3+═Ti4++Fe2+ , 当溶液出现红色达到滴定终点,用去了30.00mLFeCl3溶液,待测钛液中TiOSO4的物质的量浓度是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.化学键是分子间的强烈的相互作用
B.离子键是阴、阳离子间的强烈的相互作用
C.共价键只存在于非金属元素的原子之间
D.共价键一定只存在于共价化合物中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com