
【题目】常温下,向![]() 和NaOH混合溶液中缓慢通入
和NaOH混合溶液中缓慢通入![]() 至过量
至过量![]() 溶液温度变化忽略不计
溶液温度变化忽略不计![]() ,生成沉淀物质的量与通入
,生成沉淀物质的量与通入![]() 体积的关系如图所示。下列说法不正确的是
体积的关系如图所示。下列说法不正确的是![]()
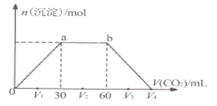
A.b点时溶质为![]()
B.横坐标轴上![]() 的值为90
的值为90
C.![]() 、
、![]() 、
、![]() 时,溶液
时,溶液![]() 中相等
中相等
D.原混合物中![]() :
:![]() ;2
;2
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】氮及其化合物的变化关系如图所示:
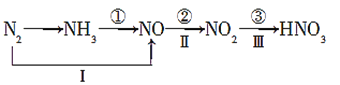
则下列说法不正确的是( )
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.反应③中,NO2作氧化剂,H2O作还原剂
D.液氨可用作制冷剂,硝酸可用于制化肥、农药、炸药、染料、盐类等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 是中学化学的常见物质,且
是中学化学的常见物质,且![]() 均含有同一种元素。在一定条件下,它们之间的相互转化关系如图所示(反应中生成的v已略去)。请回答下列问题:
均含有同一种元素。在一定条件下,它们之间的相互转化关系如图所示(反应中生成的v已略去)。请回答下列问题:
(1)若A是一种可用于自来水消毒的黄绿色气体,D是目前产量最大的金属单质,则C的化学式为_______________;写出A与C的溶液反应的离子方程式:___________________________。
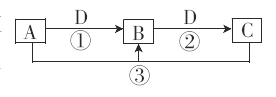
(2)若A是一种常见的强碱,D是一种气体,通常用来灭火,则反应②的离子方程式是__________________。
(3)若A是非金属固体单质,![]() 在常温下均为气体,D是空气中的主要成分,则C的化学式为________________。
在常温下均为气体,D是空气中的主要成分,则C的化学式为________________。
(4)若A是一种呈碱性的气体,![]() 为自然固氮过程,则在一定条件下反应③的化学方程式为__________________。
为自然固氮过程,则在一定条件下反应③的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) ΔH=-a kJ·mol1(a>0),其反应机理如下
2NOBr(g) ΔH=-a kJ·mol1(a>0),其反应机理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快
NOBr2(g) 快
②NO(g)+NOBr2(g) ![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 增大Br2(g)浓度能增大活化分子百分数,加快反应速率
D. 正反应的活化能比逆反应的活化能小a kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”进课堂,某化学教师为氯气与金属钠反应设计了如下装置与操作以替代相关的课本实验。实验操作:钠与氯气反应的装置作如下图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是( )
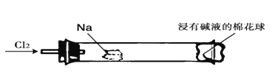
A. 反应生成的大量白烟是氯化钠晶体
B. 玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
C. 钠着火燃烧产生苍白色火焰
D. 若在棉球外沿滴一滴淀粉碘化钾溶液,据其颜色变化判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用只含有铜、铝、铁的工业废料来制备硫酸铜和硫酸铝晶体,实验流程如下:
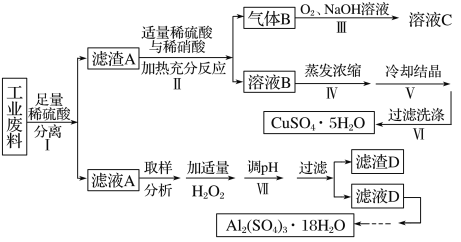
请回答:
(1)写出步骤Ⅲ中气体B与O2(足量)通入NaOH溶液中反应的化学方程式______。
(2)步骤Ⅳ蒸发浓缩的具体操作是________。
(3)下列有关实验说法正确的是________。(填编号)
A.减压过滤使用的滤纸,为确保把所有的孔都覆盖住,应使滤纸大于布氏漏斗内径
B.为得到纯净的硫酸铝晶体,采用加热烘干的方式干燥
C.步骤Ⅵ洗涤沉淀时,关小抽气泵,向布氏漏斗中加冰水没过沉淀,并用玻璃棒搅拌
D.步骤Ⅴ为得到较大的硫酸铜晶体颗粒,可投入几粒晶种并减缓溶液冷却速度
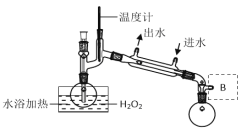
(4)H2O2浓度对反应速率有影响。通过下图所示装置将少量30% H2O2溶液浓缩至40%,B处应增加一个设备,该设备的作用是____。
(5)为测定实验所得硫酸铝晶体的纯度,进行以下实验:
步骤一:取晶体试样a g溶于20 mL水中,加适量醋酸—醋酸铵缓冲溶液,再加入过量的c1mol·L-1EDTA溶液V1mL,充分反应后稀释至250 mL。
步骤二:取25.00 mL上述稀释液,滴加指示剂,用c2mol·L-1ZnCl2溶液滴定过量的EDTA,达到终点时消耗V2mL ZnCl2溶液。
已知:M[Al2(SO4)3·18H2O]=666 g·mol -1,EDTA分别能与Al3+或Zn2+以物质的量之比1∶1进行反应。
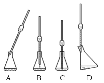
①在步骤二取上述稀释液25.00 mL于锥形瓶中,有下图所示操作(手持部分省略),其中正确的是____。(填编号)取溶液所用仪器的名称是____
②根据实验数据计算该试样中Al2(SO4)3·18H2O的纯度为____(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的镁和铜组成的混合物加入到足量的稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g。下列叙述错误的是
A. 当金属全部溶解时,电子转移的数目为0.3NA
B. 参加反应的金属的总质量3.6g<w<9.6g
C. 当金属全部溶解时,产生的NO气体的体积在标准状况下为2.24L
D. 当生成的沉淀量达到最大时,消耗NaOH溶液的体积为l00mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列实验过程完成后,最终的白色沉淀不一定是BaSO4的是( )
A.Fe(NO3)3溶液![]()
![]()
![]() 白色沉淀
白色沉淀
B.Ba(NO3)2溶液![]()
![]() 白色沉淀
白色沉淀
C.无色溶液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
D.无色溶液![]()
![]() 白色沉淀
白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应4NH3+5O2![]() 4NO+6H2O(g),下列叙述正确的是( )
4NO+6H2O(g),下列叙述正确的是( )
A.达到平衡状态,2 v正(NH3)= 3v逆(H2O)
B.单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.反应达到平衡时,反应物的转化率一定小于100%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com