


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
| A、①②③④ | B、③④⑤⑥ |
| C、②③⑤⑥ | D、③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C |
| 性质结构信息 | 单质在氯气中燃烧火焰呈黄色并产生大量白烟,所得产物的阳离子与D的阳离子电子数相同. | 单质是带有金属光泽的灰黑色固体,是信息技术的关键材料. | 最高价氧化物的水化物与其气态氢化物反应得到离子化合物D. |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
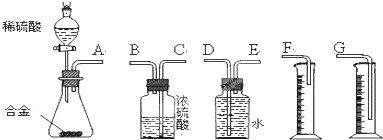
查看答案和解析>>
科目:高中化学 来源: 题型:
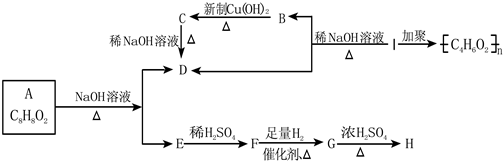 其中F能与FeCl3溶液显紫色,I为一种不饱和酯.
其中F能与FeCl3溶液显紫色,I为一种不饱和酯.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤ | B、①③⑤ |
| C、①②④⑤ | D、①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com