
【题目】某小组欲探究反应2Fe2++I2![]() 2Fe3++2I,完成如下实验:
2Fe3++2I,完成如下实验:
资料:AgI是黄色固体,不溶于稀硝酸。新制的AgI见光会少量分解。
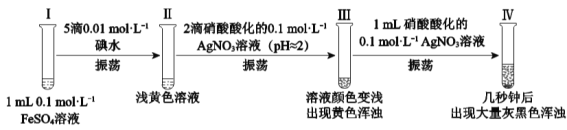
(1)Ⅰ、Ⅱ均未检出Fe3+,检验Ⅱ中有无Fe3+的实验操作及现象是:取少量Ⅱ中溶液,___。
(2)Ⅲ中的黄色浑浊是__。
(3)经检验,Ⅱ→Ⅲ的过程中产生了Fe3+。
①对Fe3+产生的原因做出如下假设:
假设a:空气中存在O2,由于___(用离子方程式表示),可产生Fe3+;
假设b:酸性溶液中NO3具有氧化性,可产生Fe3+;
假设c:___;
假设d:该条件下,I2溶液可将Fe2+氧化为Fe3+。
②通过实验进一步证实a、b、c不是产生Fe3+的主要原因,假设d成立。Ⅱ→Ⅲ的过程中I2溶液氧化Fe2+的原因是___。
(4)经检验,Ⅳ中灰黑色浑浊中含有AgI和Ag。
①验证灰黑色浑浊含有Ag的实验操作及现象是:取洗净后的灰黑色固体,___。
②为探究Ⅲ→Ⅳ出现灰黑色浑浊的原因,完成了实验1和实验2。
实验1:向1mL0.1 mol·L1 FeSO4溶液中加入1mL0.1mol·L1AgNO3溶液,开始时,溶液无明显变化。几分钟后,出现大量灰黑色浑浊。反应过程中温度几乎无变化。测定溶液中Ag+浓度随反应时间的变化如图。

实验2:实验开始时,先向试管中加入几滴Fe2(SO4)3溶液,重复实验1,实验结果与实验1相同。
ⅰ.实验1中发生反应的离子方程式是___。
ⅱ.Ⅳ中迅速出现灰黑色浑浊的可能的原因是___。
【答案】滴加几滴KSCN溶液,溶液不变红 AgI 4Fe2++O2+4H+=4Fe3++2H2O 溶液中Ag+具有氧化性,可产生Fe3+ Ag+与I生成了AgI沉淀,降低了I的浓度,使平衡2Fe2++I2![]() 2Fe3++2I正向移动,使I2氧化了Fe2+ 加入足量稀硝酸,振荡,固体部分溶解,产生无色气泡,遇空气变红棕色。静置,取上层清液加入稀盐酸,有白色沉淀生成 Fe2++Ag+=Fe3++Ag AgI分解产生的Ag催化了Fe2+与Ag+的反应
2Fe3++2I正向移动,使I2氧化了Fe2+ 加入足量稀硝酸,振荡,固体部分溶解,产生无色气泡,遇空气变红棕色。静置,取上层清液加入稀盐酸,有白色沉淀生成 Fe2++Ag+=Fe3++Ag AgI分解产生的Ag催化了Fe2+与Ag+的反应
【解析】
(1)、铁离子遇到KSCN溶液变红色;
(2)、AgI是黄色固体,不溶于稀硝酸;
(3)①、亚铁离子被氧气氧化生成铁离子;
②、Ag+与I生成了AgI沉淀,降低了I的浓度,使平衡2Fe2++I2=2 Fe3++2I-正向移动;
(4)①、验证灰黑色浑浊含有Ag的实验操作及现象是加入硝酸溶解后生成一氧化氮气体遇到空气变红棕色,溶液中加入盐酸生成白色沉淀;
②i向1 mL 0.1 mol/LFeSO4溶液中加入1 mL0.1 mol/LAgNO3溶液,开始时,溶液无明显变化。几分钟后,出现大量灰黑色浑浊,说明银离子氧化亚铁离子生成铁离子,银离子如氧化亚铁离子,则发生Ag++Fe2+=Ag+Fe3+;
ii经检验,IV中灰黑色浑浊中含有AgI和Ag,ii.IV中迅速出现灰黑色浑浊的可能的原因是快速发生反应Ag++Fe2+=Ag+Fe3+。
(1)、检验II中无Fe3+ 的实验操作及现象是:取少量II中溶液,滴加几滴KSCN溶液,溶液不变红,故答案为:滴加几滴KSCN溶液,溶液不变红;
(2)、分析可知,反应I中的黄色浑浊是AgI ,故答案为:AgI ;
(3)①、空气中存在O2,由于发生反应4Fe2++O2+4H+=4Fe3++2H2O,可产生Fe3+,溶液中Ag+具有氧化性,可产生Fe3+,酸性溶液中NO3-具有氧化性,可产生Fe3+,该条件下,I2溶液可将Fe2+氧化为Fe3+,故答案为: 4Fe2++O2+4H+=4Fe3++2H2O;溶液中Ag+具有氧化性,可产生Fe3+;
②、通过实验进一-步证实a、b、c不是产生Fe3+的主要原因,假设d成立,Ⅱ→Ⅲ的过程中I2溶液氧化Fe2+的原因是: Ag+与I-生成了AgI沉淀,降低了I-的浓度,使平衡2Fe2++I2=2 Fe3++2I-正向移动,使I2氧化了Fe2+,故答案为:Ag+与I生成了AgI沉淀,降低了I的浓度,使平衡2Fe2++I2![]() 2Fe3++2I正向移动,使I2氧化了Fe2+ ;
2Fe3++2I正向移动,使I2氧化了Fe2+ ;
(4)①验证灰黑色浑浊含有Ag的实验操作及现象是:取洗净后的灰黑色固体,加入足量稀硝酸,振荡,固体部分溶解,产生无色气泡,遇空气变红棕色。静置,取上层清液加入稀盐酸,有白色沉淀生成。
故答案为:加入足量稀硝酸,振荡,固体部分溶解,产生无色气泡,遇空气变红棕色。静置,取上层清液加入稀盐酸,有白色沉淀生成;
②i、实验1中发生反应的离子方程式是:Fe2++Ag+=Fe3++Ag,
故答案为:Fe2++Ag+=Fe3++Ag;
ii、iiIV中迅速出现灰黑色浑浊的可能的原因是:AgI分解产生的Ag催化了Fe2+与Ag+的反应。
故答案为:AgI分解产生的Ag催化了Fe2+与Ag+的反应;


科目:高中化学 来源: 题型:
【题目】4℃时500 mL水中溶解了112L氯化氢气体(在标准状况下测得)。下列关于所形成溶液的说法中正确的是( )
A.该溶液溶质的物质的量浓度为10mol·L1
B.该溶液溶质的质量分数约为26.7%
C.该溶液溶质的物质的量浓度因溶液的密度未知而无法求得
D.该溶液溶质的质量分数因溶液的密度未知而无法求得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用碳酸钠晶体(Na2CO3·10H2O,相对分子质量286)来配制0.1mol/L的碳酸钠溶液980mL,假如其他操作均准确无误,下列情况会引起配制溶液的浓度偏高的是
A. 称取碳酸钠晶体28.6g
B. 溶解时进行加热,并将热溶液转移到容量瓶中至刻度线
C. 转移时,对用于溶解碳酸钠晶体的烧杯没有进行洗涤
D. 定容后,将容量瓶振荡摇匀,静置发现液面低于刻度线,又加入少量水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X中可能含有下列离子中的若干种:Cl-、![]() 、
、![]() 、
、![]() 、Na+、Mg2+、Fe3+,为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如下实验(必要时可加热),下列说法不正确的是
、Na+、Mg2+、Fe3+,为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如下实验(必要时可加热),下列说法不正确的是
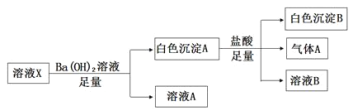
A.气体A可能是CO2或SO2
B.溶液X中一定存在![]()
C.溶液X中一定不存在Fe3+和Mg2+,可能存在Na+
D.向溶液A加入硝酸酸化的硝酸银溶液可能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.现有以下物质:①NaCl固体;②液态CO2;③液态氯化氢;④汞;⑤固体BaSO4;⑥蔗糖;⑦酒精;⑧熔融的Na2CO3,请回答下列问题:
(1)以上物质中能导电的是____;
(2)以上物质属于电解质的是____;
(3)以上物质属于非电解质的是____;
(4)以上物质溶于水后形成的溶液能导电的是_____;
(5)属于盐的有____;
(6)写出⑧溶于水中的电离方程式____。
Ⅱ.在一定条件下,有下列物质:①8gCH4②6.02×1023个HCl分子③2molO2。按由小到大的顺序填写下列空白(填写序号):
(1)摩尔质量____;(2)物质的量_____;
(3)分子数目_____;(4)原子数目____;
(5)质量_____。
III.(1)分离胶体和溶液常用的方法叫____;
(2)等质量的O2和O3所含原子个数比为____;
(3)若ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.根据如图给出的装置图回答下列问题:
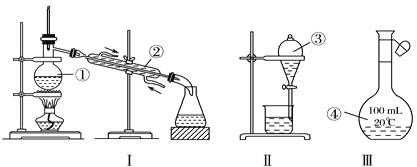
(1)写出图中玻璃仪器的名称:①____;②____;③_____。
(2)①~④中,使用前必须检查是否漏水的是___、___(填仪器序号),分离溴水中的溴应先选择装置___(填Ⅰ、Ⅱ或Ⅲ序号)。
Ⅱ.某同学帮助水质检测站配制480mL0.5mol·L-1NaOH溶液备用。请回答下列问题:
(1)该同学用到的玻璃仪器有烧杯、量筒、玻璃棒、___、胶头滴管。
(2)该同学用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体,则称取的总质量为___克。
(3)配制时,其正确的操作顺序如下,请填充所缺步骤。
A.在盛有NaOH固体的烧杯中加入适量水溶解;
B.将烧杯中冷却的溶液沿玻璃棒注入容量瓶中;
C.用少量水___2次~3次,洗涤液均注入容量瓶,振荡。
D.继续往容量瓶内小心加水,直到液面接近刻度___处,改用胶头滴管加水,使溶液___。
E.将容量瓶盖紧,反复上下颠倒,摇匀。
(4)若出现如下情况,其中将引起所配溶液浓度偏低的是____(填编号)
①容量瓶实验前用蒸馏水洗干净,但未烘干 ②定容观察液面时俯视
③配制过程中遗漏了(3)中步骤C ④加蒸馏水时不慎超过了刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一学生设计入图所示装置进行NaHCO3的分解,并证实产物中有CO2产生。

(1)试管中发生的化学反应方程式是____________________________。
(2)指出该学生设计的装置图的错误之处,并改正(文字说明即可)(至少2处)____________。
(3)烧杯中发生反应的离子方程式是_______________________________。
(4)如果将16.8gNaHCO3加热一段时间,然后将剩余固体溶于水,并加入足量的CaCl2溶液,最终得到白色沉淀5.0g,则NaHCO3分解百分率为______________,加CaCl2后反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关说法正确的是
A. 1mol/L NaCl 的溶液中含有NA个钠离子
B. 标准状况下,22.4L SO3中含有SO3分子数为NA
C. 1molFe与1molCl2充分反应,转移电子数2NA
D. 1molNa2O2与足量CO2反应,转移的电子数2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中时刻存在着含氮元素不同物质间的转化,实现氮按照一定的方向转化一直是科学领域研究的重要课题。氮气在催化剂作用下的一系列转化如图所示:
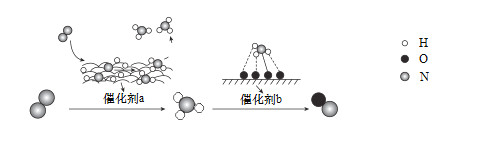
下列叙述正确的是
A.N2转化为NH3、NH3转化为NO均属于氮的固定
B.在催化剂a的作用下,氮原子发生了氧化反应
C.催化剂a、b表面均发生了极性共价键的断裂
D.催化剂a、b均可以提高单位时间内反应物的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com