
【题目】纳米级Fe粉是新型材料,具有超强磁性、高效催化性。某化学小组探究用氢气和碳酸亚铁制取纳米级铁粉。其实验设计如图(加热、支持装置省略)
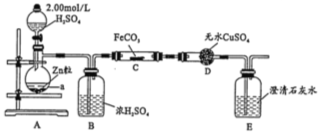
(1)a的名称是________________;浓硫酸的作用是________________。
(2)打开分液漏斗活塞,一段时间后再对C装置加热,这样操作的目的是_______________;反应一段时间后D中变蓝,E中溶液变浑浊,C中发生反应的化学方程式为______________。
(3)反应中若观察到B装置中气泡产生过快,则应进行的操作是_____________________。
(4)反应一段时间后,B中产生气泡太慢,再滴加硫酸反应速率略有加快但不明显;若向硫酸中加少量硫酸铜再滴入与Zn反应,反应速率明显加快,原因是____________________。
(5)检验碳酸亚铁中含有铁元素的实验方法是______________________。
【答案】
(1)蒸馏烧瓶(1分)吸收氢气中的水蒸气(或干燥氢气)(2分)
(2)排除体系内的空气,防止干挠实验,防止爆炸(2分)FeCO3+H2![]() Fe+CO2+H2O(2分)
Fe+CO2+H2O(2分)
(3)调节A中分液漏斗活塞,减慢硫酸滴加速度(2分,不全对扣1分)
(4)锌与硫酸铜反应生成铜,铜与锌形成原电池(锌为负极),加快了反应速率(2分)
(5)取少量FeCO3加适量盐酸完全溶解,再加入少量K3[Fe(CN)3]溶液,产生蓝色沉淀,则碳酸亚铁中含有铁元素。(溶解后加入氧化剂,检验Fe3+也可) (2分)
【解析】
试题分析:本题的实验目的是用氢气和碳酸亚铁制取纳米级铁粉,根据装置分析可知,A为H2的制取装置,B为干燥装置,C为H2还原FeCO3制取纳米级铁粉。D中无色硫酸铜可用于检验水的存在,E中澄清石灰水则用于检验CO2。
(1)仪器a是圆底烧瓶;B为干燥装置,所以浓硫酸的作用是吸收氢气中的水蒸气。
(2)因H2是爆炸气体,所以在操作时必须先排除装置中的空气,必须打开分液漏斗活塞,一段时间后再对C装置加热,防止装置中的空气干挠实验,造成爆炸的危险。反应一段时间后D中变蓝,说明有水生成,E中溶液变浑浊,说明有CO2生成。则C中发生反应的化学方程式为FeCO3+H2![]() Fe+CO2+H2O。
Fe+CO2+H2O。
(3)反应中若观察到B装置中气泡产生过快,则说明A处产生H2的速率过快,可调节A中分液漏斗活塞,减慢硫酸滴加速度。
(4)加少量硫酸铜再滴入与Zn反应,锌与硫酸铜反应生成铜,铜与锌形成原电池(锌为负极),加快了反应速率。
(5)检验碳酸亚铁中含有铁元素的实验方法是取少量FeCO3加适量盐酸完全溶解,再加入少量K3[Fe(CN)3]溶液,产生蓝色沉淀,则碳酸亚铁中含有铁元素。。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】SOCl2(亚硫酰氯)是一种无色或淡黄色发烟液体,遇水或醇分解成二氧化硫和氯化氢,用途广泛。已知:SO2+Cl2+SCl2=2SOCl2。
(1)SCl2的电子式为_____________________;
(2)上述SOCl2的制备反应中,生成1molSOCl2时转移_______mol电子。
(3)SOCl2与足量NaHCO3溶液反应的离子方程式为_____________________;
(4)无水AlCl3是有机反应的催化剂,也是制备无水四氯铝酸锂(LiAlCl4)的原料,可由AlCl3溶液浓缩结晶得到AlCl3·6H2O,再脱水得到AlCl3。
①若将AlCl3溶液蒸发至干并充分灼烧,则最终得到的固体产物为______________(填化学式)。
②AlCl3·6H2O中加入SOCl2并加热可制得无水氯化铝。SOCl2的作用是________________________________(用文字和方程式说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类的生活息息相关,下列有关说法正确的是
A.因铝表面能形成致密的氧化膜,所以铝制餐具可以长期使用
B.有机玻璃(聚甲基丙烯酸甲酯)是通过缩聚反应制得的
C.SiO2用途广泛,因其高熔点的特性成为光导纤维的主要原料
D.因废弃物易污染环境,腈纶不宜大量取代棉、麻等天然材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个石墨作电极,电解稀的Na2SO4溶液的装置,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液。下列有关叙述正确的是
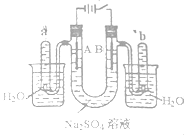
A.逸出气体的体积,A电极的小于B电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.A电极附近呈红色,B电极附近呈蓝色
D.电解一段时间后,将全部电解液转移到同一烧杯中,充分搅拌后溶解呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修5:有机化学基础】
G为合成抗脑损伤药物中间体,F能发生银镜反应。合成G的路线如下:
已知:
(1)烃A的名称为_______________;G中的官能团名称是_____________。
(2)D→E的化学反应方程式为____________________;F的结构简式为__________________。
(3)检验B中官能团的试剂为___________。
(4)满足下称条件的G的同分异构体有__________种。
①与氯化铁能发生显色反应 ②苯环上一氯代物只有一种 ③核磁共振氢谱只有五种吸收峰
(5)由G合成抗脑损伤药物L的合成路线如下:
H的结构简式为___________;②写出K的结构简式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲使醋酸溶液中的CH3COO-浓度增大,电离平衡向电离方向移动,且不放出气体,可向醋酸溶液中加入少量固体
A.NaOH B.NaHCO3 C.CH3COONa D.Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组学生用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热。下列说法正确的是( )
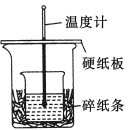
A.如图条件下实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填碎纸条的主要作用是固定小烧杯
D.若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,从理论上说所求放出热量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得:
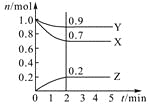
(1)该反应的化学方程式为 。
(2)反应开始至2 min,用Y表示的平均反应速率为 ,X的转化率为 。
(3)在一定温度下,下列情况可作为上述反应达到反应限度的标志的是 。
A.X、Y、Z的浓度相等 |
B.X、Y、Z的分子数比为3︰1︰2 |
C.Z的生成速率是Y的生成速率的二倍 |
D.单位时间内生成n mol Y,同时生成3n mol X |
(4)在密闭容器里,通入a mol A(g)和b mol B(g),
发生反应A(g)+ B(g)= 2C(g),当改变下列条件时,会加快反应速率的是 (填序号)。
①降低温度
②保持容器的体积不变,充入氦气
③加入催化剂
④保持容器的体积不变,增加A(g)的物质的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com